Moet de stekker eruit? Bepaling van de diepte van coma.
Aan de hand van de "Glascow Coma Scale" valt het instellen van coma gemakkelijk te evalueren. Meten van verandering in het niveau van bewustzijn tijdens herstel daarentegen is moeilijker. In de kliniek is het gebruik van de "JFK Coma Recovery Scale – Revised" (CRS-R) hiervoor algemeen verspreid. Nieuwe beoordelingsmethodes worden onderzocht en vergeleken met de CRS-R. Tot dusver is het echter niet duidelijk in hoeverre de CRS-R zelf zo betrouwbaar is, en men kan zich hierbij afvragen of dit niet leidt tot foute conclusies: misschien is de betrouwbaarheid van de nieuwere meetmethodes wel beter dan die van de CSR-R? Er is dus nood aan meer kritisch vergelijkend onderzoek tussen CRS-R en alternatieve methodes.
Evolutie van coma
Coma is een staat van bewustzijnsverlies waarbij de ogen van de patiënt gesloten blijven ondanks hevige stimulatie. Een comateuze patiënt is niet prikkelbaar en men veronderstelt dat hij geen besef heeft van zichzelf, van zijn omgeving en dat er geen dag/nachtritme aanwezig is. Als patiënten niet afdalen naar hersendood, kunnen ze – doorgaans na twee tot vier weken – wakkerder worden en geleidelijk aan herstellen. Ze evolueren naar een vegetatieve status/toestand (= UWS: unresponsive wakefulness syndrome) of nog verder naar een staat van minimaal bewustzijn (= MCS: minimally conscious state). Het onderscheid tussen UWS en MCS kan zeer moeilijk zijn, maar is van groot prognostisch en therapeutisch belang. UWS wordt namelijk gekenmerkt door het sporadisch openen van de ogen en door het aanwezig zijn van een slaap/waakritme, maar deze patiënten hebben geen besef van hun omgeving en vertonen enkel reflexmatig gedrag. MCS daarentegen is een toestand waarin er een zeker besef is van zichzelf en/of van de omgeving, en waarin niet-reflexmatig gedrag wordt vastgesteld. Een patiënt in UWS kan evolueren naar MCS en van daaruit kan mogelijks verdere evolutie naar normaal bewustzijn optreden.
Indien patiënten met een niet-traumatisch hersenletsel na 3 maanden in UWS-toestand blijven, wordt deze toestand als irreversibel beschouwd en kan medisch beslist worden om de therapie en ondersteuning stop te zetten. Bij traumatische hersenletsels is er na 3 maanden wel nog een kleine kans op opklaren van het bewustzijn, en wacht men 12 maanden af om de UWS als permanente toestand te beschouwen.
Huidige beoordeling
Op heden gebruikt men een schaal – de CRS-R – om beide toestanden van elkaar te onderscheiden. De schaal bestaat uit 23 onderwerpen, onderverdeeld in 6 subschalen waarin ze hiërarchisch geordend zijn. Getrainde onderzoekers en herhaalde metingen zijn nodig voor een stabiele inschatting van de toestand van de patiënt. Het betrouwbaar afnemen en scoren van de CRS-R wordt bemoeilijkt bij aanwezigheid van motorische gebreken, blindheid, doofheid, niet kunnen spreken en wisselingen in waakzaamheid – factoren die na een verworven hersenletsel vaak aanwezig zijn en die idealiter een correcte meting van bewustzijn niet zouden mogen verstoren.
Beeldvorming als alternatief
Eén van de methodes is het gebruik van hersengolven waargenomen door middel van een elektro-encefalogram (EEG). Hersengolven vertonen verscheidene kenmerken waarvan sommige significante verschillen aantonen tussen patiënten in UWS en patiënten in MCS. Op basis van deze verschillen heeft men getracht beide bewustzijnstoestanden van elkaar te onderscheiden met de CRS-R als controle. Men heeft ondervonden dat het gebruik van meerdere EEG-kenmerken ter differentiatie leidde tot een beter onderscheid en betere overeenkomst met de CRS-R. Een andere methode is positron-emissietomografie (PET) en voornamelijk 18Fluorodesoxyglucose-PET (FDG-PET), waarbij het glucosemetabolisme van de hersenen wordt bestudeerd. Aan de hand van de verschillen op FDG-PET probeerde men UWS van MCS onderscheiden met CRS-R als controle. Hierbij werd geobserveerd dat de metabolismesnelheid van glucose ter hoogte van de hersenschors op FDG-PET de beste overeenkomst vertoonde met de schaal. Een laatste beeldvormingstechniek is het gebruik van functionele MRI (fMRI) waarbij wordt gekeken naar de hersenenactiviteit wanneer men aan de patiënt iets vraagt of wanneer men de patiënt iets beveelt. Bij fMRI bestaan ook significante verschillen tussen UWS en MCS, maar zijn amper studies uitgevoerd waarbij men op basis van deze verschillen trachtte de bewustzijnstoestand te bepalen.
Figuur 1: EEG
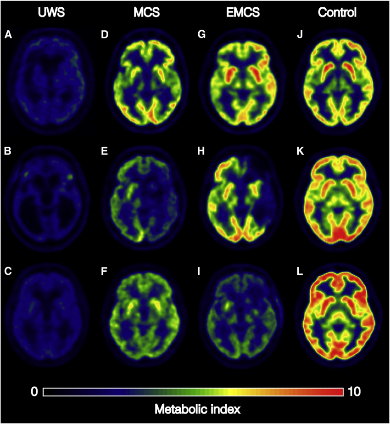 Figuur 2: FDG-PET
Figuur 2: FDG-PET
Figuur 3: fMRI
CRS-R verfijnen of vervangen
Omdat de CRS-R niet feilloos is, werd om te beginnen onderzocht of er factoren waren die de schaal konden beïnvloeden, om zo het gebruik ervan te optimaliseren. Zo heeft het tijdstip van afname een invloed op de score van de CRS-R, waarbij die significant hoger – en dus beter – was in de ochtend. Ook een meer ervaren afnemer leidt tot significant hogere scores. De aanwezigheid van mantelzorgers daarentegen kan de score zowel positief als negatief beïnvloeden, maar niet op een significante wijze. Ook werd gedacht aan een aanpassing van de schaal. Dit gebeurde bijvoorbeeld bij de “modified score” van de CRS-R (CRS-R/MS). Hierbij werd een schaal gehanteerd van 0 tot 100 met een grenswaarde van 8,34, waarbij vanaf deze waarde de patiënt beschouwd kon worden als in MCS. Een andere verbetering die werd voorgesteld is het gebruik van zelfverwijzende auditieve en visuele prikkels – zoals het horen van de eigen naam of het kijken in een spiegel – wat leidde tot significant hogere scores voor bewustzijn.
Verder werden nieuwe schalen opgesteld en onderzocht zoals de “music therapy assessment tool for awareness in disorders of consciousness” (MATADOC), die op basis van muziek de bewustzijnstoestand tracht te beoordelen. Deze schaal werd voornamelijk bij kinderen een interessant alternatief bevonden.
Besluit
Onderzoeken en scoren van de bewustzijnstoestand blijft zelfs voor ervaren clinici een delicate aangelegenheid. Hoewel reeds veel onderzoek werd verricht naar aanvullende technische onderzoeken om de betrouwbaarheid van de klinische diagnose te verhogen, is verder onderzoek nodig. Naast kennis van de beïnvloedende factoren op de score van de CRS-R, blijven een kritische ingesteldheid ten opzichte van gemeten scores en overleg met expert-onderzoekers op vlak van bewustzijnsstoornissen essentieel voor een zo goed mogelijke inschatting.
Bibliografie
1. Laureys S, Owen AM, Schiff ND. Brain function in coma, vegetative state, and related disorders. Lancet Neurol. 2004;3(9):537-46.
2. Greicius MD, Krasnow B, Reiss AL, Menon V. Functional connectivity in the resting brain: a network analysis of the default mode hypothesis. Proc Natl Acad Sci U S A. 2003;100(1):253-8.
3. The vegetative state: guidance on diagnosis and management. Clin Med (Lond). 2003;3(3):249-54.
4. Laureys S, Celesia GG, Cohadon F, Lavrijsen J, Leon-Carrion J, Sannita WG, et al. Unresponsive wakefulness syndrome: a new name for the vegetative state or apallic syndrome. BMC Med. 2010;8:68.
5. Medical aspects of the persistent vegetative state (2). The Multi-Society Task Force on PVS. N Engl J Med. 1994;330(22):1572-9.
6. Giacino JT, Ashwal S, Childs N, Cranford R, Jennett B, Katz DI, et al. The minimally conscious state: definition and diagnostic criteria. Neurology. 2002;58(3):349-53.
7. Giacino JT, Kalmar K, Whyte J. The JFK Coma Recovery Scale-Revised: measurement characteristics and diagnostic utility. Arch Phys Med Rehabil. 2004;85(12):2020-9.
8. Bruno MA, Vanhaudenhuyse A, Thibaut A, Moonen G, Laureys S. From unresponsive wakefulness to minimally conscious PLUS and functional locked-in syndromes: recent advances in our understanding of disorders of consciousness. J Neurol. 2011;258(7):1373-84.
9. Bruno MA, Majerus S, Boly M, Vanhaudenhuyse A, Schnakers C, Gosseries O, et al. Functional neuroanatomy underlying the clinical subcategorization of minimally conscious state patients. J Neurol. 2012;259(6):1087-98.
10. McDonnell E, Giacino JT, Kolakowsky-Hayner SA. A brief overview of the Coma Recovery Scale-revised: updates from the COMBI. J Head Trauma Rehabil. 2015;30(2):143-5.
11. Seel RT, Sherer M, Whyte J, Katz DI, Giacino JT, Rosenbaum AM, et al. Assessment scales for disorders of consciousness: evidence-based recommendations for clinical practice and research. Arch Phys Med Rehabil. 2010;91(12):1795-813.
12. Gerrard P, Zafonte R, Giacino JT. Coma Recovery Scale-Revised: evidentiary support for hierarchical grading of level of consciousness. Arch Phys Med Rehabil. 2014;95(12):2335-41.
13. Lovstad M, Froslie KF, Giacino JT, Skandsen T, Anke A, Schanke AK. Reliability and diagnostic characteristics of the JFK coma recovery scale-revised: exploring the influence of rater's level of experience. J Head Trauma Rehabil. 2010;25(5):349-56.
14. Schnakers C, Vanhaudenhuyse A, Giacino J, Ventura M, Boly M, Majerus S, et al. Diagnostic accuracy of the vegetative and minimally conscious state: clinical consensus versus standardized neurobehavioral assessment. BMC Neurol. 2009;9:35.
15. Farisco M, Petrini C. Misdiagnosis as an ethical and scientific challenge. Ann Ist Super Sanita. 2014;50(3):229-33.
16. Schnakers C. Clinical assessment of patients with disorders of consciousness. Arch Ital Biol. 2012;150(2-3):36-43.
17. Whyte J, Nordenbo AM, Kalmar K, Merges B, Bagiella E, Chang H, et al. Medical complications during inpatient rehabilitation among patients with traumatic disorders of consciousness. Arch Phys Med Rehabil. 2013;94(10):1877-83.
18. Lehembre R, Gosseries O, Lugo Z, Jedidi Z, Chatelle C, Sadzot B, et al. Electrophysiological investigations of brain function in coma, vegetative and minimally conscious patients. Arch Ital Biol. 2012;150(2-3):122-39.
19. Guerit JM, Amantini A, Amodio P, Andersen KV, Butler S, de Weerd A, et al. Consensus on the use of neurophysiological tests in the intensive care unit (ICU): electroencephalogram (EEG), evoked potentials (EP), and electroneuromyography (ENMG). Neurophysiol Clin. 2009;39(2):71-83.
20. Synek VM. Prognostically important EEG coma patterns in diffuse anoxic and traumatic encephalopathies in adults. J Clin Neurophysiol. 1988;5(2):161-74.
21. Michel CM, Murray MM, Lantz G, Gonzalez S, Spinelli L, Grave de Peralta R. EEG source imaging. Clin Neurophysiol. 2004;115(10):2195-222.
22. Cologan V, Schabus M, Ledoux D, Moonen G, Maquet P, Laureys S. Sleep in disorders of consciousness. Sleep Med Rev. 2010;14(2):97-105.
23. Landsness E, Bruno MA, Noirhomme Q, Riedner B, Gosseries O, Schnakers C, et al. Electrophysiological correlates of behavioural changes in vigilance in vegetative state and minimally conscious state. Brain. 2011;134(Pt 8):2222-32.
24. Malinowska U, Chatelle C, Bruno MA, Noirhomme Q, Laureys S, Durka PJ. Electroencephalographic profiles for differentiation of disorders of consciousness. Biomed Eng Online. 2013;12:109.
25. Rossi Sebastiano D, Panzica F, Visani E, Rotondi F, Scaioli V, Leonardi M, et al. Significance of multiple neurophysiological measures in patients with chronic disorders of consciousness. Clin Neurophysiol. 2015;126(3):558-64.
26. Gosseries O, Schnakers C, Ledoux D, Vanhaudenhuyse A, Bruno MA, Demertzi A, et al. Automated EEG entropy measurements in coma, vegetative state/unresponsive wakefulness syndrome and minimally conscious state. Functional neurology. 2011;26(1):25-30.
27. Wu DY, Cai G, Yuan Y, Liu L, Li GQ, Song WQ, et al. Application of nonlinear dynamics analysis in assessing unconsciousness: a preliminary study. Clin Neurophysiol. 2011;122(3):490-8.
28. Thul A, Lechinger J, Donis J, Michitsch G, Pichler G, Kochs EF, et al. EEG entropy measures indicate decrease of cortical information processing in Disorders of Consciousness. Clin Neurophysiol. 2016;127(2):1419-27.
29. Sitt JD, King JR, El Karoui I, Rohaut B, Faugeras F, Gramfort A, et al. Large scale screening of neural signatures of consciousness in patients in a vegetative or minimally conscious state. Brain. 2014;137(Pt 8):2258-70.
30. Schnakers C, Ledoux D, Majerus S, Damas P, Damas F, Lambermont B, et al. Diagnostic and prognostic use of bispectral index in coma, vegetative state and related disorders. Brain Inj. 2008;22(12):926-31.
31. Di Perri C, Thibaut A, Heine L, Soddu A, Demertzi A, Laureys S. Measuring consciousness in coma and related states. World J Radiol. 2014;6(8):589-97.
32. Casali AG, Gosseries O, Rosanova M, Boly M, Sarasso S, Casali KR, et al. A theoretically based index of consciousness independent of sensory processing and behavior. Sci Transl Med. 2013;5(198):198ra05.
33. Pisani LR, Naro A, Leo A, Arico I, Pisani F, Silvestri R, et al. Repetitive transcranial magnetic stimulation induced slow wave activity modification: A possible role in disorder of consciousness differential diagnosis? Conscious Cogn. 2015;38:1-8.
34. Fingelkurts AA, Fingelkurts AA, Bagnato S, Boccagni C, Galardi G. EEG oscillatory states as neuro-phenomenology of consciousness as revealed from patients in vegetative and minimally conscious states. Conscious Cogn. 2012;21(1):149-69.
35. Lehembre R, Marie-Aurelie B, Vanhaudenhuyse A, Chatelle C, Cologan V, Leclercq Y, et al. Resting-state EEG study of comatose patients: a connectivity and frequency analysis to find differences between vegetative and minimally conscious states. Functional neurology. 2012;27(1):41-7.
36. Bonfiglio L, Piarulli A, Olcese U, Andre P, Arrighi P, Frisoli A, et al. Spectral parameters modulation and source localization of blink-related alpha and low-beta oscillations differentiate minimally conscious state from vegetative state/unresponsive wakefulness syndrome. PLoS One. 2014;9(3):e93252.
37. Holler Y, Thomschewski A, Bergmann J, Kronbichler M, Crone JS, Schmid EV, et al. Connectivity biomarkers can differentiate patients with different levels of consciousness. Clin Neurophysiol. 2014;125(8):1545-55.
38. Baccalá LA, Sameshima K, Takahashi D, editors. Generalized partial directed coherence. 2007 15th International Conference on Digital Signal Processing; 2007: IEEE.
39. Kaminski M, Blinowska KJ. A new method of the description of the information flow in the brain structures. Biological cybernetics. 1991;65(3):203-10.
40. Gersch W, Goddard G. Epileptic focus location: spectral analysis method. Science. 1970;169(3946):701-2.
41. Fischer C, Luaute J, Adeleine P, Morlet D. Predictive value of sensory and cognitive evoked potentials for awakening from coma. Neurology. 2004;63(4):669-73.
42. Gawryluk JR, D'Arcy RC, Connolly JF, Weaver DF. Improving the clinical assessment of consciousness with advances in electrophysiological and neuroimaging techniques. BMC Neurol. 2010;10:11.
43. Real RG, Veser S, Erlbeck H, Risetti M, Vogel D, Muller F, et al. Information processing in patients in vegetative and minimally conscious states. Clin Neurophysiol. 2016;127(2):1395-402.
44. Northoff G, Heiss WD. Why is the distinction between neural predispositions, prerequisites, and correlates of the level of consciousness clinically relevant?: Functional brain imaging in coma and vegetative state. Stroke. 2015;46(4):1147-51.
45. Stender J, Gosseries O, Bruno MA, Charland-Verville V, Vanhaudenhuyse A, Demertzi A, et al. Diagnostic precision of PET imaging and functional MRI in disorders of consciousness: a clinical validation study. Lancet. 2014;384(9942):514-22.
46. Stender J, Kupers R, Rodell A, Thibaut A, Chatelle C, Bruno MA, et al. Quantitative rates of brain glucose metabolism distinguish minimally conscious from vegetative state patients. J Cereb Blood Flow Metab. 2015;35(1):58-65.
47. Fernandez-Espejo D, Bekinschtein T, Monti MM, Pickard JD, Junque C, Coleman MR, et al. Diffusion weighted imaging distinguishes the vegetative state from the minimally conscious state. NeuroImage. 2011;54(1):103-12.
48. Demertzi A, Antonopoulos G, Heine L, Voss HU, Crone JS, de Los Angeles C, et al. Intrinsic functional connectivity differentiates minimally conscious from unresponsive patients. Brain. 2015;138(Pt 9):2619-31.
49. Vanhaudenhuyse A, Noirhomme Q, Tshibanda LJ, Bruno MA, Boveroux P, Schnakers C, et al. Default network connectivity reflects the level of consciousness in non-communicative brain-damaged patients. Brain. 2010;133(Pt 1):161-71.
50. Huang Z, Dai R, Wu X, Yang Z, Liu D, Hu J, et al. The self and its resting state in consciousness: an investigation of the vegetative state. Human brain mapping. 2014;35(5):1997-2008.
51. Kotchoubey B, Merz S, Lang S, Markl A, Muller F, Yu T, et al. Global functional connectivity reveals highly significant differences between the vegetative and the minimally conscious state. J Neurol. 2013;260(4):975-83.
52. Di HB, Yu SM, Weng XC, Laureys S, Yu D, Li JQ, et al. Cerebral response to patient's own name in the vegetative and minimally conscious states. Neurology. 2007;68(12):895-9.
53. Qin P, Di H, Liu Y, Yu S, Gong Q, Duncan N, et al. Anterior cingulate activity and the self in disorders of consciousness. Human brain mapping. 2010;31(12):1993-2002.
54. Monti MM, Vanhaudenhuyse A, Coleman MR, Boly M, Pickard JD, Tshibanda L, et al. Willful modulation of brain activity in disorders of consciousness. N Engl J Med. 2010;362(7):579-89.
55. Charland-Verville V, Lesenfants D, Sela L, Noirhomme Q, Ziegler E, Chatelle C, et al. Detection of response to command using voluntary control of breathing in disorders of consciousness. Front Hum Neurosci. 2014;8:1020.
56. Magee WL, Siegert RJ, Daveson BA, Lenton-Smith G, Taylor SM. Music therapy assessment tool for awareness in disorders of consciousness (MATADOC): standardisation of the principal subscale to assess awareness in patients with disorders of consciousness. Neuropsychol Rehabil. 2014;24(1):101-24.
57. Magee WL, Ghetti CM, Moyer A. Feasibility of the music therapy assessment tool for awareness in disorders of consciousness (MATADOC) for use with pediatric populations. Front Psychol. 2015;6:698.
58. Riganello F, Cortese MD, Dolce G, Lucca LF, Sannita WG. The Autonomic System Functional State Predicts Responsiveness in Disorder of Consciousness. J Neurotrauma. 2015;32(14):1071-7.
59. Cortese M, Riganello F, Arcuri F, Pugliese M, Lucca L, Dolce G, et al. Coma recovery scale-r: variability in the disorder of consciousness. BMC Neurol. 2015;15(1):186.
60. Sattin D, Giovannetti AM, Ciaraffa F, Covelli V, Bersano A, Nigri A, et al. Assessment of patients with disorder of consciousness: do different Coma Recovery Scale scoring correlate with different settings? J Neurol. 2014;261(12):2378-86.
61. Di H, Nie Y, Hu X, Tong Y, Heine L, Wannez S, et al. Assessment of visual fixation in vegetative and minimally conscious states. BMC Neurol. 2014;14:147.
62. Sattin D, Minati L, Rossi D, Covelli V, Giovannetti AM, Rosazza C, et al. The Coma Recovery Scale Modified Score: a new scoring system for the Coma Recovery Scale-revised for assessment of patients with disorders of consciousness. International journal of rehabilitation research Internationale Zeitschrift fur Rehabilitationsforschung Revue internationale de recherches de readaptation. 2015;38(4):350-6.
63. Gilutz Y, Lazary A, Karpin H, Vatine JJ, Misha T, Fortinsky H, et al. Detailed behavioral assessment promotes accurate diagnosis in patients with disorders of consciousness. Front Hum Neurosci. 2015;9:87.