Kan de behandeling van hersentumoren op jonge leeftijd leiden tot Alzheimer?
Alsof de diagnose van een hersentumor op jonge leeftijd nog niet erg genoeg is, blijken er nu aanwijzingen te zijn dat de behandeling grotere risico’s met zich meebrengt dan voorheen gedacht. In België krijgen ruim 50 tot 100 kinderen per jaar de diagnose: hersentumor. Eén op vier overleeft het niet, maar wat met de levenskwaliteit van de overlevenden? Uit recent onderzoek is namelijk gebleken dat er een mogelijke link is tussen bestralen van de hersenen op jonge leeftijd, vroegtijdige veroudering van de hersenen en het versneld ontwikkelen van de ziekte van Alzheimer. Dit is bijzonder zorgwekkend voor jonge kinderen aan de start van hun leven en verdient daarom een beter en meer uitgebreid onderzoek. Is er nood aan het aanpassen van de stralingsdosis of aan het ontwikkelen van nieuwe medicijnen om de gezonde hersenen voldoende te beschermen?
Hersentumor diagnose als kind, wat nu?
De meest succesvolle behandeling voor het tweede meest voorkomende kankertype bij kinderen, namelijk hersentumoren, bestaat naast een operatie uit radiotherapie. Radiotherapie is een behandeling waarbij ioniserende stralen, meer bepaald X-stralen, specifiek gericht worden op kankercellen met de bedoeling om deze te doen stoppen met groeien en uiteindelijk te doden. Met een overlevingskans van 75% kan dit aanzien worden als een succesvolle behandeling, ware het niet dat dit onvermijdelijk gepaard gaat met een verhoogde kans op latere bijwerkingen. Bovendien lopen kinderen meer kans op het ontwikkelen van hersenstoornissen dan volwassenen, doordat hun ontwikkelende en groeiende hersenen vele malen gevoeliger zijn aan straling. Voorbeelden van zulke late bijwerkingen zijn leerproblemen, geheugenstoornissen en een lager IQ, niet bepaald een leuk vooruitzicht eens het kind kankervrij is.
Veroudering van de hersenen en Alzheimer
Vele van de late bijwerkingen van radiotherapie doen denken aan de symptomen van ouder worden en meer specifiek, de ziekte van Alzheimer. Denk maar aan het zich niet meer kunnen herinneren wat je gisteren gekocht hebt of waar die winkel nu precies was, moeilijkheden met het vinden en begrijpen van woorden en begrippen, tot verschillen in gedragingen. Vaak zijn deze ouderdomssymptomen te wijten aan het beschadigen van de hippocampus, ook wel het zeepaardje van de hersenen genoemd door zijn kenmerkende structuur. Het is dit deeltje van de hersenen dat instaat voor geheugen en de mogelijkheid tot leren, en waar gedurende heel het leven nieuwe hersencellen gevormd worden. Bovendien toonde eerder onderzoek reeds aan dat straling ter hoogte van de hersenen een verstoorde werking van de hippocampus kan veroorzaken. Hoewel er duidelijke gelijkenissen zijn tussen late stralings-geïnduceerde effecten en veroudering van de hersenen, zijn de exacte werkingsmechanismen die hiervoor verantwoordelijk zijn nog niet gekend. Bovendien, blijft een link met het ontwikkelen van de ziekte van Alzheimer speculatief. Willen we deze link leggen en de kennis van de onderliggende oorzaken vergroten, moet er onderzoek verricht worden naar het effect van blootstelling van stralingsgevoelige, ontwikkelende hersenen aan radiotherapie.
Alzheimermuis op de proef
Om de mogelijke effecten van ioniserende straling op hersenen te bestuderen, werd gebruik gemaakt van een muismodel. Aangezien normale muizen de ziekte van Alzheimer niet kunnen krijgen, werd een muis gebruikt die genetisch gemanipuleerd is om de twee belangrijkste kenmerken van de ziekte van Alzheimer, namelijk eiwitten genaamd amyloid-beta en gefosforyleerd tau, tot uiting te brengen. Het ziektepatroon bij dit muismodel, dat bovendien ook geheugenverlies vertoont, is uitstekend vergelijkbaar met de ziekteontwikkeling bij Alzheimerpatiënten. De muizen werden bestraald met één fractie van radiotherapie, dat ook bij hersentumoren bij kinderen gehanteerd wordt. Dit gebeurde op een leeftijd van 10 dagen, hetgeen overeenkomt met de periode waarin de muizenhersenen het meest gevoelig zijn aan straling. Vlak na de bestraling (1 uur) alsook op langere termijn (3 en 6 maanden) werd gekeken naar een reeks biologische kenmerken van hersenveroudering en naar het ontwikkelen van Alzheimer pathologie in het ‘zeepaardje’ van de hersenen.
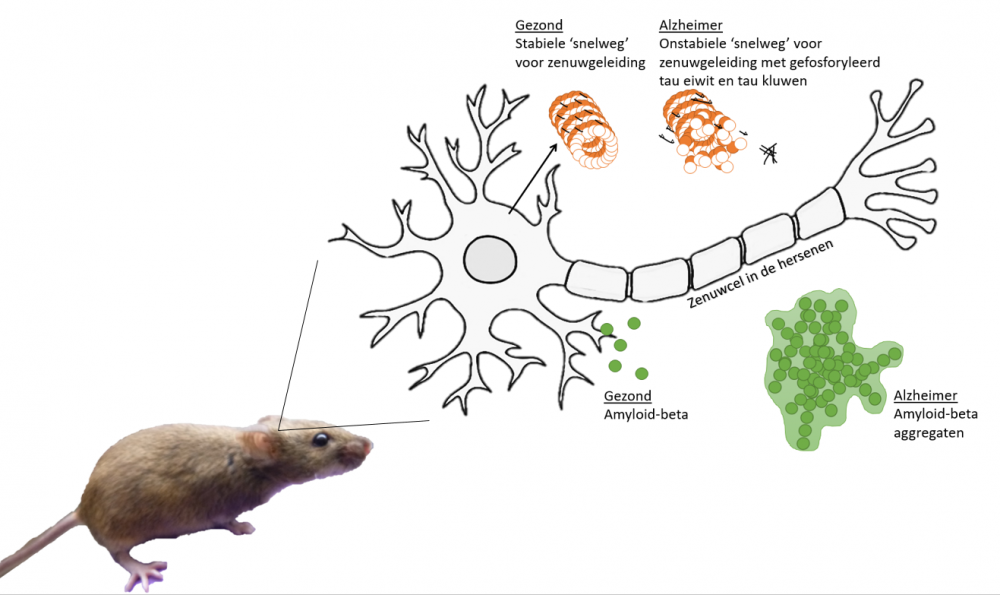
Eerste bewijs voor Alzheimer pathologie na bestraling van jonge muizenhersenen
Een eerste kenmerk van straling is beschadiging van het DNA, hetgeen inderdaad kon worden vastgesteld in de bestraalde ontwikkelende hersenen. Of deze schade hersteld kan worden of eerder permanent is, zal toekomstig onderzoek verder moeten uitwijzen. In tweede instantie werd gekeken naar de algemene gezondheid en groei van bestraalde muizen, waar er geen invloed van straling gedurende 6 maanden na blootstelling gezien kon worden. Hoewel er uiterlijk dus geen verschillen te bespeuren vielen, was het een ander verhaal wanneer in meer detail gekeken werd naar het hersenweefsel zelf. Na bestraling kon een vermindering vastgesteld worden in het aantal delende cellen in de hippocampus, wat dus gelinkt kan worden aan stralings-geïnduceerde geheugenstoornissen en mogelijks aan hersenveroudering. Met andere woorden, zonder deze cellen, is het moeilijk om nieuwe gebeurtenissen te herinneren en te onthouden. Tot slot werden de kenmerken van de ziekte van Alzheimer onder de loep genomen. Bij 6 maanden oude muizen kon voor het eerst vastgesteld worden dat bestraling op jonge leeftijd zorgt voor een verhoogd niveau aan gefosforyleerde tau. Dit is een belangrijke indicator van Alzheimer ontwikkeling en kan in een laat stadium bijdragen tot het afsterven van een hersencel. We kunnen dus concluderen dat deze resultaten een eerste puzzelstukje zijn in de link tussen straling en het (vervroegd) ontwikkelen van de ziekte van Alzheimer.
Met andere woorden zijn deze bevindingen een verder bewijs voor de nefaste werking van bestraling op jonge hersenen. Dit onderzoek zal dus bijdragen tot het beter opvolgen van pediatrische kankerpatiënten gedurende hun leven. Bovendien werd de kennis inzake de risicofactoren voor de ziekte van Alzheimer vergroot, hetgeen van groot belang is in onze steeds ouder wordende populatie. Uiteraard is dit slechts het topje van de ijsberg en is verder onderzoek nodig om te weten of de stralingsdosis in radiotherapie aangepast moet worden, want: voorkomen is nog steeds beter dan genezen.
Bibliografie
ACADEMIC. 2017. Hippocampus [Online].Available: https://medicine.academic.ru/3923/Hippocampus [Accessed 11 December 2017].
AJITHKUMAR, T., PRICE, S., HORAN, G., BURKE, A. & JEFFERIES, S. 2017. Prevention of radiotherapy-induced neurocognitive dysfunction in survivors of paediatric brain tumours: the potential role of modern imaging and radiotherapy techniques. Lancet Oncol, 18, e91-e100.
ALIZADEH, E., ORLANDO, T. M. & SANCHE, L. 2015. Biomolecular damage induced by ionizing radiation: the direct and indirect effects of low-energy electrons on DNA. Annu Rev Phys Chem, 66, 379-98.
ANDERSON, P., MORRIS, R., AMARAL, D., BLISS, T. & O'KEEFE, J. 2007. The Hippocampus Book, USA, Oxford University Press.
APPLE, D. M., SOLANO-FONSECA, R. & KOKOVAY, E. 2017. Neurogenesis in the aging brain. Biochem Pharmacol, 141, 77-85.
AUCHTER, A. M. & MONFILS, M. H. 2015. Limbic System A2 - Wright, James D. International Encyclopedia of the Social & Behavioral Sciences (Second Edition). Oxford: Elsevier.
AUNAN, J. R., WATSON, M. M., HAGLAND, H. R. & SOREIDE, K. 2016. Molecular and biological hallmarks of ageing. Br J Surg, 103, e29-46.
BALENTOVA, S. & ADAMKOV, M. 2015. Molecular, Cellular and Functional Effects of Radiation-Induced Brain Injury: A Review. Int J Mol Sci, 16, 27796-815.
BEAR, M. F., CONNORS, B. W. & PARADISO, M. A. 2016. Neuroscience: exploring the brain, Philadelphia, Wolters Kluwer.
BEGUM, N., WANG, B., MORI, M. & VARES, G. 2012. Does ionizing radiation influence Alzheimer's disease risk? J Radiat Res, 53, 815-22.
BEYZADEOGLU, M. 2010. Basic Radiation Oncology, Berlin, Heidelberg : Springer Berlin Heidelberg : Imprint Springer.
BIZON, J. L. & WOODS, A. G. 2009. Animal models of human cognitive aging, New York : Humana Press.
BORDERS, A. A., ALY, M., PARKS, C. M. & YONELINAS, A. P. 2017. The hippocampus is particularly important for building associations across stimulus domains. Neuropsychologia, 99, 335-342.
BRAYNE, C., GILL, C., HUPPERT, F. A., BARKLEY, C., GEHLHAAR, E., GIRLING, D. M., O'CONNOR, D. W. & PAYKEL, E. S. 1995. Incidence of clinically diagnosed subtypes of dementia in an elderly population. Cambridge Project for Later Life. Br J Psychiatry, 167, 255-62.
BRENNER, D. J. & HALL, E. J. 2007. Computed tomography--an increasing source of radiation exposure. N Engl J Med. United States.
BRYAN, A. S., MENNO, P. W., ED, S. L. & EDVARD, I. M. 2014. Functional organization of the hippocampal longitudinal axis. Nature Reviews Neuroscience, 15, 655.
BURATOVIC, S., STENERLOW, B., FREDRIKSSON, A., SUNDELL-BERGMAN, S., VIBERG, H. & ERIKSSON, P. 2014. Neonatal exposure to a moderate dose of ionizing radiation causes behavioural defects and altered levels of tau protein in mice. Neurotoxicology, 45, 48-55.
BUTTERFIELD, D. A., REED, T., NEWMAN, S. F. & SULTANA, R. 2007. Roles of Amyloid β-Peptide-Associated Oxidative Stress and Brain Protein Modifications in the Pathogenesis of Alzheimer's Disease and Mild Cognitive Impairment. Free Radic Biol Med, 43, 658-77.
CANYILMAZ, E., USLU, G. D. H., COLAK, F., HAZERAL, B., HACIISLAMOGLU, E., ZENGIN, A. Y., SARI, A. & YONEY, A. 2015. Comparison of dose distributions hippocampus in high grade gliomas irradiation with linac-based imrt and volumetric arc therapy: a dosimetric study. Springerplus, 4.
CARDENAS-AGUAYO MDEL, C., GOMEZ-VIRGILIO, L., DEROSA, S. & MERAZ-RIOS, M. A. 2014. The role of tau oligomers in the onset of Alzheimer's disease neuropathology. ACS Chem Neurosci, 5, 1178-91.
CASCIATI, A., DOBOS, K., ANTONELLI, F., BENEDEK, A., KEMPF, S. J., BELLÉS, M., BALOGH, A., TANORI, M., HEREDIA, L., ATKINSON, M. J., VON TOERNE, C., AZIMZADEH, O., SARAN, A., SÁFRÁNY, G., BENOTMANE, M. A., LINARES-VIDAL, M. V., TAPIO, S., LUMNICZKY, K. & PAZZAGLIA, S. 2016. Age-related effects of X-ray irradiation on mouse hippocampus. Oncotarget, 7, 28040-58.
CHANG, D. S. L., FOSTER D. DAS, I NDRA J. MENDONCA, MARC S. DYNLACHT, JOSEPH R. 2014. Basic Radiotherapy Physics and Biology, New York, Springer International Publishing.
CHEIGNON, C., TOMAS, M., BONNEFONT-ROUSSELOT, D., FALLER, P., HUREAU, C. & COLLIN, F. 2018. Oxidative stress and the amyloid beta peptide in Alzheimer's disease. Redox Biol, 14, 450-464.
CHENG, Z., LI, Y. Q. & WONG, C. S. 2016. Effects of Aging on Hippocampal Neurogenesis After Irradiation. Int J Radiat Oncol Biol Phys, 94, 1181-9.
CHERRY, J. D., LIU, B., FROST, J. L., LEMERE, C. A., WILLIAMS, J. P., OLSCHOWKA, J. A. & O'BANION, M. K. 2012. Galactic cosmic radiation leads to cognitive impairment and increased abeta plaque accumulation in a mouse model of Alzheimer's disease. PLoS One, 7, e53275.
CLARK, R. E. & SQUIRE, L. R. 2013. Similarity in form and function of the hippocampus in rodents, monkeys, and humans. Proc Natl Acad Sci U S A, 110, 10365-70.
COLOMBO, P. J., CRAWLEY, M. E., EAST, B. S. & HILL, A. R. 2012. Aging and the Brain, Elsevier Inc.
DALY, B. P., EICHEN, D. M., BAILER, B., BROWN, R. T. & BUCHANAN, C. L. 2012. Central Nervous System A2 - Ramachandran, V.S. Encyclopedia of Human Behavior (Second Edition). San Diego: Academic Press.
DE STROOPER, B. & KARRAN, E. 2016. The Cellular Phase of Alzheimer's Disease. Cell, 164, 603-15.
DENG, W., AIMONE, J. B. & GAGE, F. H. 2010. New neurons and new memories: how does adult hippocampal neurogenesis affect learning and memory? Nature Reviews Neuroscience, 11, 339-350.
DERDIKMAN, D. K., JAMES J. 2014. Space,Time and Memory in the Hippocampal Formation, Wien, Springer.
DOMENECH, H. 2017. Radiation Safety: Management and Programs, Switzerland, Springer International Publishing.
DUVERNOY, H. M. C., FRANCOISE RISOLD, PIERRE-YVES 2013. The Human Hippocampus, Springer-Verlag Berlin Heidelberg.
ETIENNE, O., ROQUE, T., HATON, C. & BOUSSIN, F. D. 2012. Variation of radiation-sensitivity of neural stem and progenitor cell populations within the developing mouse brain. Int J Radiat Biol, 88, 694-702.
FRED, H. L. 2004. Drawbacks and limitations of computed tomography: views from a medical educator. Tex Heart Inst J, 31, 345-8.
GIBSON, D. A., MOORIN, R. E., SEMMENS, J., HOLMAN, D. & ARCY, J. 2014. The disproportionate risk burden of CT scanning on females and younger adults in Australia: a retrospective cohort study. Australian and New Zealand Journal of Public Health, 38, 441-448.
GODYN, J., JONCZYK, J., PANEK, D. & MALAWSKA, B. 2016. Therapeutic strategies for Alzheimer's disease in clinical trials. Pharmacol Rep, 68, 127-38.
GOITEIN, M. 2008. Radiation Oncology: A Physicist's-Eye View, New York, Springer-Verlag New York.
GOLD, M. & KHOURY, J. E. 2015. β-amyloid, Microglia and the Inflammasome in Alzheimer’s Disease. Semin Immunopathol, 37, 607-11.
GREENE-SCHLOESSER, D., ROBBINS, M. E., PEIFFER, A. M., SHAW, E. G., WHEELER, K. T. & CHAN, M. D. 2012. Radiation-induced brain injury: A review. Front Oncol, 2, 73.
GRUPEN, C. 2010. Introduction to Radiation Protection: Practical Knowledge for Handling Radioactive Sources, Verlag Berlin Heidelberg, Springer.
GRUPEN, C. R., MARK 2016. Radioactivity and Radiation: What They Are, What They Do, and How to Harness Them, Switzerland, Springer International Publishing.
GUPTA, T. K. 2013. Radiation, Ionization, and Detection in Nuclear Medicine, Verlag Berlin Heidelberg, Springer-Verlag Berlin Heidelberg.
HALL, P., ADAMI, H. O., TRICHOPOULOS, D., PEDERSEN, N. L., LAGIOU, P., EKBOM, A., INGVAR, M., LUNDELL, M. & GRANATH, F. 2004. Effect of low doses of ionising radiation in infancy on cognitive function in adulthood: Swedish population based cohort study. Bmj, 328, 19.
HAN, W., UMEKAWA, T., ZHOU, K., ZHANG, X. M., OHSHIMA, M., DOMINGUEZ, C. A., HARRIS, R. A., ZHU, C. & BLOMGREN, K. 2016. Cranial irradiation induces transient microglia accumulation, followed by long-lasting inflammation and loss of microglia. Oncotarget, 7, 82305-23.
HARADA, C. N., NATELSON LOVE, M. C. & TRIEBEL, K. 2013. Normal Cognitive Aging. Clin Geriatr Med, 29, 737-52.
HARMANN, D. 2009. Gamma ray science [Online]. Available: http://ecuip.lib.uchicago.edu/multiwavelength-astronomy/gamma-ray/scien… [Accessed 20 December 2017].
HAWKINS, B. E., KRISHNAMURTHY, S., CASTILLO-CARRANZA, D. L., SENGUPTA, U., PROUGH, D. S., JACKSON, G. R., DEWITT, D. S. & KAYED, R. 2013. Rapid accumulation of endogenous tau oligomers in a rat model of traumatic brain injury: possible link between traumatic brain injury and sporadic tauopathies. J Biol Chem, 288, 17042-50.
HENRY, M. S., PASSMORE, A. P., TODD, S., MCGUINNESS, B., CRAIG, D. & JOHNSTON, J. A. 2013. The development of effective biomarkers for Alzheimer's disease: a review. Int J Geriatr Psychiatry, 28, 331-40.
HERNANDEZ, L., TERRADAS, M., CAMPS, J., MARTIN, M., TUSELL, L. & GENESCA, A. 2015. Aging and radiation: bad companions. Aging Cell, 14, 153-61.
HUANG, W. J., ZHANG, X. & CHEN, W. W. 2016. Role of oxidative stress in Alzheimer's disease. Biomed Rep, 4, 519-22.
HUDSON, D., KOVALCHUK, I., KOTURBASH, I., KOLB, B., MARTIN, O. A. & KOVALCHUK, O. 2011. Induction and persistence of radiation-induced DNA damage is more pronounced in young animals than in old animals. Aging (Albany NY), 3, 609-20.
JOINER, M. & VAN DER KOGEL, A. 2009. Basic clinical radiobiology, London, Hodder Arnold.
KEMPERMANN, G., SONG, H. & GAGE, F. H. 2015. Neurogenesis in the Adult Hippocampus. Cold Spring Harb Perspect Biol, 7, a018812.
KEMPF, S. J., AZIMZADEH, O., ATKINSON, M. J. & TAPIO, S. 2013. Long-term effects of ionising radiation on the brain: cause for concern? Radiat Environ Biophys, 52, 5-16.
KEMPF, S. J., CASCIATI, A., BURATOVIC, S., JANIK, D., TOERNE, C., UEFFING, M., NEFF, F., MOERTL, S., STENERLÖW, B., SARAN, A., ATKINSON, M. J., ERIKSSON, P., PAZZAGLIA, S. & TAPIO, S. 2014. The cognitive defects of neonatally irradiated mice are accompanied by changed synaptic plasticity, adult neurogenesis and neuroinflammation. Mol Neurodegener, 9.
KEMPF, S. J., JANIK, D., BARJAKTAROVIC, Z., BRAGA-TANAKA, I., TANAKA, S., NEFF, F., SARAN, A., LARSEN, M. R. & TAPIO, S. 2016. Chronic low-dose-rate ionising radiation affects the hippocampal phosphoproteome in the ApoE−/− Alzheimer's mouse model. Oncotarget, 7, 71817-32.
KIRSCH, D. G. & TARBELL, N. J. 2004. Conformal radiation therapy for childhood CNS tumors. Oncologist, 9, 442-50.
KNIERIM, J. J. 2015. The hippocampus. Current Biology, 25, R1116-R1121.
KOWALD, A. & KIRKWOOD, T. B. 2016. Can aging be programmed? A critical literature review. Aging Cell.
KUHN, H. G. 2015. Neural stem cells in development, adulthood and disease, New York : Humana Press.
KUMAR, A., SINGH, A. & EKAVALI 2015. A review on Alzheimer's disease pathophysiology and its management: an update. Pharmacol Rep, 67, 195-203.
LAGACE, D. C., FISCHER, S. J. & EISCH, A. J. 2007. Gender and endogenous levels of estradiol do not influence adult hippocampal neurogenesis in mice. Hippocampus, 17, 175-80.
LANE, C. A., HARDY, J. & SCHOTT, J. M. 2017. Alzheimer's disease. European journal of neurology.
LAU, L.-F. & BRODNEY, M. A. 2008. Alzheimer' s disease, Berlin, London, Springer.
LI, L., WANG, W., WELFORD, S., ZHANG, T., WANG, X. & ZHU, X. 2014. Ionizing radiation causes increased tau phosphorylation in primary neurons. J Neurochem, 131, 86-93.
LLORENS-MARTÍN, M. & TREJO, J. L. 2011. Multiple Birthdating Analyses in Adult Neurogenesis: A Line-Up of the Usual Suspects. Front Neurosci, 5.
LOMAX, M. E., FOLKES, L. K. & O'NEILL, P. 2013. Biological consequences of radiation-induced DNA damage: relevance to radiotherapy. Clin Oncol (R Coll Radiol), 25, 578-85.
LOWE, X. R., BHATTACHARYA, S., MARCHETTI, F. & WYROBEK, A. J. 2009. Early brain response to low-dose radiation exposure involves molecular networks and pathways associated with cognitive functions, advanced aging and Alzheimer's disease. Radiat Res, 171, 53-65.
LUMNICZKY, K., SZATMÁRI, T. & SÁFRÁNY, G. 2017. Ionizing Radiation-Induced Immune and Inflammatory Reactions in the Brain. Front Immunol, 8.
LÓPEZ-OTÍN, C., BLASCO, M. A., PARTRIDGE, L., SERRANO, M. & KROEMER, G. 2013. The Hallmarks of Aging. Cell, 153, 1194-217.
MANDREKAR, S. & LANDRETH, G. E. 2010. Microglia and Inflammation in Alzheimer’s Disease. CNS Neurol Disord Drug Targets, 9, 156-67.
MARIANI, E., POLIDORI, M. C., CHERUBINI, A. & MECOCCI, P. 2005. Oxidative stress in brain aging, neurodegenerative and vascular diseases: an overview. J Chromatogr B Analyt Technol Biomed Life Sci, 827, 65-75.
MARTIN, A., HARBISON, S., BEACH, K. & COLE, P. 2012. An introduction to radiation protection London, Hodder Arnold.
MITCHELL, G. 2013. The rationale for fractionation in radiotherapy. Clin J Oncol Nurs, 17, 412-7.
MIZUMATSU, S., MONJE, M. L., MORHARDT, D. R., ROLA, R., PALMER, T. D. & FIKE, J. R. 2003. Extreme sensitivity of adult neurogenesis to low doses of X-irradiation. Cancer Res, 63, 4021-7.
MORISHIMA-KAWASHIMA, M. & IHARA, Y. 2002. Alzheimer's disease: beta-Amyloid protein and tau. J Neurosci Res, 70, 392-401.
MU, Y. & GAGE, F. H. 2011. Adult hippocampal neurogenesis and its role in Alzheimer's disease. Mol Neurodegener, 6, 85.
NATIONAL CANCER INSTITUTE. 2010. Radiation therapy for cancer [Online]. Available: https://www.cancer.gov/about-cancer/treatment/types/radiation-therapy/r… [Accessed 15th november 2017].
NAYLOR, A. S., BULL, C., NILSSON, M. K. L., ZHU, C., BJÖRK-ERIKSSON, T., ERIKSSON, P. S., BLOMGREN, K. & KUHN, H. G. 2008. Voluntary running rescues adult hippocampal neurogenesis after irradiation of the young mouse brain. Proc Natl Acad Sci U S A, 105, 14632-7.
NEMEC, K. 2013. Tips on preventing Alzheimer's disease naturally [Online]. Available: http://www.totalhealthinstitute.com/tips-on-preventing-alzheimers-disea… [Accessed 20 December 2017].
NICCOLI, T. & PARTRIDGE, L. 2012. Ageing as a Risk Factor for Disease. Curr. Biol.
NICOLAS, M. & HASSAN, B. A. 2014. Amyloid precursor protein and neural development. Development, 141, 2543-8.
ODDO, S., CACCAMO, A., SHEPHERD, J. D., MURPHY, M. P., GOLDE, T. E., KAYED, R., METHERATE, R., MATTSON, M. P., AKBARI, Y. & LAFERLA, F. M. 2003. Triple-transgenic model of Alzheimer's disease with plaques and tangles: intracellular Abeta and synaptic dysfunction. Neuron, 39, 409-21.
O’SHEA, A., COHEN, R. A., PORGES, E. C., NISSIM, N. R. & WOODS, A. J. 2016. Cognitive Aging and the Hippocampus in Older Adults. Front Aging Neurosci, 8.
PATTERSON, C., FEIGHTNER, J. W., GARCIA, A., HSIUNG, G. Y. R., MACKNIGHT, C. & SADOVNICK, A. D. 2008. Diagnosis and treatment of dementia: 1. Risk assessment and primary prevention of Alzheimer disease. Cmaj, 178, 548-56.
PETERS, R. 2006. Ageing and the brain. Postgrad Med J, 82, 84-8.
PODGORSAK, E. B. 2010. Radiation Physics for Medical Physicists, Verlag Berlin Heidelberg, Springer.
RAJMOHAN, V. & MOHANDAS, E. 2007. The limbic system. Indian J Psychiatry, 49, 132-9.
RAO, A. A., YE, H., DECKER, P. A., HOWE, C. L. & WETMORE, C. 2011. Therapeutic doses of cranial irradiation induce hippocampus-dependent cognitive deficits in young mice. J Neurooncol, 105, 191-8.
RESENDE, R., MOREIRA, P. I., PROENCA, T., DESHPANDE, A., BUSCIGLIO, J., PEREIRA, C. & OLIVEIRA, C. R. 2008. Brain oxidative stress in a triple-transgenic mouse model of Alzheimer disease. Free Radic Biol Med, 44, 2051-7.
RICHARDSON, R. B. 2009. Ionizing radiation and aging: rejuvenating an old idea. Aging (Albany NY), 1, 887-902.
RIVA, D. & GIORGI, C. 2000. The neurodevelopmental price of survival in children with malignant brain tumours. Childs Nerv Syst, 16, 751-4.
ROBINSON, K. E., KUTTESCH, J. F., CHAMPION, J. E., ANDREOTTI, C. F., HIPP, D. W., BETTIS, A., BARNWELL, A. & COMPAS, B. E. 2010. A quantitative meta-analysis of neurocognitive sequelae in survivors of pediatric brain tumors. Pediatr Blood Cancer, 55, 525-31.
RODGERS, S. P., TREVINO, M., ZAWASKI, J. A., GABER, M. W. & LEASURE, J. L. 2013. Neurogenesis, Exercise, and Cognitive Late Effects of Pediatric Radiotherapy. Neural Plast, 2013.
RODRIGUEZ, J. J., JONES, V. C., TABUCHI, M., ALLAN, S. M., KNIGHT, E. M., LAFERLA, F. M., ODDO, S. & VERKHRATSKY, A. 2008. Impaired adult neurogenesis in the dentate gyrus of a triple transgenic mouse model of Alzheimer's disease. PLoS One, 3, e2935.
ROLA, R., RABER, J., RIZK, A., OTSUKA, S., VANDENBERG, S. R., MORHARDT, D. R. & FIKE, J. R. 2004. Radiation-induced impairment of hippocampal neurogenesis is associated with cognitive deficits in young mice. Exp Neurol, 188, 316-30.
ROXO, M. R., FRANCESCHINI, P. R., ZUBARAN, C., KLEBER, F. D. & SANDER, J. W. 2011. The Limbic System Conception and Its Historical Evolution. ScientificWorldJournal, 11, 2428-41.
RUITENBERG, A., OTT, A., VAN SWIETEN, J. C., HOFMAN, A. & BRETELER, M. M. 2001. Incidence of dementia: does gender make a difference? Neurobiol Aging, 22, 575-80.
SANDOR, N., WALTER, F. R., BOCSIK, A., SANTHA, P., SCHILLING-TOTH, B., LENER, V., VARGA, Z., KAHAN, Z., DELI, M. A., SAFRANY, G. & HEGYESI, H. 2014. Low dose cranial irradiation-induced cerebrovascular damage is reversible in mice. PLoS One, 9, e112397.
SAYRE, L. M., ZELASKO, D. A., HARRIS, P. L., PERRY, G., SALOMON, R. G. & SMITH, M. A. 1997. 4-Hydroxynonenal-derived advanced lipid peroxidation end products are increased in Alzheimer's disease. J Neurochem, 68, 2092-7.
SCHELTENS, P., BLENNOW, K., BRETELER, M. M. B., DE STROOPER, B., FRISONI, G. B., SALLOWAY, S. & VAN DER FLIER, W. M. 2016. Alzheimer's disease. Lancet (London, England), 388, 505.
SCHMIDT, R., KIENBACHER, E., BENKE, T., DAL-BIANCO, P., DELAZER, M., LADURNER, G., JELLINGER, K., MARKSTEINER, J., RANSMAYR, G., SCHMIDT, H., STOGMANN, E., FRIEDRICH, J. & WEHRINGER, C. 2008. [Sex differences in Alzheimer's disease]. Neuropsychiatr, 22, 1-15.
SCHUESSEL, K., LEUTNER, S., CAIRNS, N. J., MULLER, W. E. & ECKERT, A. 2004. Impact of gender on upregulation of antioxidant defence mechanisms in Alzheimer's disease brain. J Neural Transm (Vienna), 111, 1167-82.
SEDELNIKOVA, O. A., HORIKAWA, I., REDON, C., NAKAMURA, A., ZIMONJIC, D. B., POPESCU, N. C. & BONNER, W. M. 2008. Delayed kinetics of DNA double-strand break processing in normal and pathological aging. Aging Cell, 7, 89-100.
SEIB, D. R. & MARTIN-VILLALBA, A. 2015. Neurogenesis in the Normal Ageing Hippocampus: A Mini-Review. Gerontology, 61, 327-35.
SERRANO-POZO, A., FROSCH, M. P., MASLIAH, E. & HYMAN, B. T. 2011. Neuropathological alterations in Alzheimer disease. Cold Spring Harb Perspect Med, 1, a006189.
SHARMA, A., SINGH, K. & ALMASAN, A. 2012. Histone H2AX phosphorylation: a marker for DNA damage. Methods Mol Biol, 920, 613-26.
SILVA, A. R., SANTOS, A. C., FARFEL, J. M., GRINBERG, L. T., FERRETTI, R. E., CAMPOS, A. H., CUNHA, I. W., BEGNAMI, M. D., ROCHA, R. M., CARRARO, D. M., DE BRAGANCA PEREIRA, C. A., JACOB-FILHO, W. & BRENTANI, H. 2014. Repair of oxidative DNA damage, cell-cycle regulation and neuronal death may influence the clinical manifestation of Alzheimer's disease. PLoS One, 9, e99897.
SIMIC, G., BABIC LEKO, M., WRAY, S., HARRINGTON, C., DELALLE, I., JOVANOV-MILOSEVIC, N., BAZADONA, D., BUEE, L., DE SILVA, R., DI GIOVANNI, G., WISCHIK, C. & HOF, P. R. 2016. Tau Protein Hyperphosphorylation and Aggregation in Alzheimer's Disease and Other Tauopathies, and Possible Neuroprotective Strategies. Biomolecules, 6, 6.
SMALL, S. A., SCHOBEL, S. A., BUXTON, R. B., WITTER, M. P. & BARNES, C. A. 2011. A pathophysiological framework of hippocampal dysfunction in ageing and disease. Nat Rev Neurosci, 12, 585-601.
SMITH-BINDMAN, R., LIPSON, J., MARCUS, R., KIM, K. P., MAHESH, M., GOULD, R., BERRINGTON DE GONZALEZ, A. & MIGLIORETTI, D. L. 2009. Radiation dose associated with common computed tomography examinations and the associated lifetime attributable risk of cancer. Arch Intern Med, 169, 2078-86.
SOKOLOWSKI, K. & CORBIN, J. G. 2012. Wired for behaviors: from development to function of innate limbic system circuitry. Front Mol Neurosci, 5.
SOLITO, E. & SASTRE, M. 2012. Microglia Function in Alzheimer’s Disease. Front Pharmacol, 3.
SON, Y., YANG, M., WANG, H. & MOON, C. 2015. Hippocampal dysfunctions caused by cranial irradiation: a review of the experimental evidence. Brain Behav Immun, 45, 287-96.
SPRING, K. R. & DAVIDSON, M. W. 2018. Introduction to fluorescence microscopy [Online]. Nikon Instruments Inc. Available: https://www.microscopyu.com/techniques/fluorescence/introduction-to-flu… [Accessed 15 March 2018].
STERNICZUK, R., ANTLE, M. C., LAFERLA, F. M. & DYCK, R. H. 2010. Characterization of the 3xTg-AD mouse model of Alzheimer's disease: part 2. Behavioral and cognitive changes. Brain Res, 1348, 149-55.
SUMAN, S., RODRIGUEZ, O. C., WINTERS, T. A., FORNACE, A. J., JR., ALBANESE, C. & DATTA, K. 2013. Therapeutic and space radiation exposure of mouse brain causes impaired DNA repair response and premature senescence by chronic oxidant production. Aging (Albany NY), 5, 607-22.
TAGAYA, M. & SIMMEN, T. 2017. Organelle Contact Sites : From Molecular Mechanism to Disease, Singapore: Springer Singapore Pte. Limited.
TANAPAT, P., HASTINGS, N. B., REEVES, A. J. & GOULD, E. 1999. Estrogen stimulates a transient increase in the number of new neurons in the dentate gyrus of the adult female rat. J Neurosci, 19, 5792-801.
TANG, F. R., LOKE, W. K. & KHOO, B. C. 2017. Postnatal irradiation-induced hippocampal neuropathology, cognitive impairment and aging. Brain Dev, 39, 277-293.
THERMOFISHER. Fluorescence Spectra Viewer [Online]. Available: https://www.thermofisher.com/be/en/home/life-science/cell-analysis/labe… [Accessed 16 March 2018].
VANDENBERGHE, R. & TOURNOY, J. 2005. Cognitive aging and Alzheimer's disease. 81, 343-352.
VARELA-NALLAR, L. & INESTROSA, N. C. 2013. Wnt signaling in the regulation of adult hippocampal neurogenesis. Front Cell Neurosci, 7, 100.
VERHEYDE, J. & BENOTMANE, M. A. 2007. Unraveling the fundamental molecular mechanisms of morphological and cognitive defects in the irradiated brain. Brain Res Rev, 53, 312-20.
VIGNARD, J., MIREY, G. & SALLES, B. 2013. Ionizing-radiation induced DNA double-strand breaks: a direct and indirect lighting up. Radiother Oncol, 108, 362-9.
WANG, B., TANAKA, K., JI, B., ONO, M., FANG, Y., NINOMIYA, Y., MARUYAMA, K., IZUMI-NAKAJIMA, N., BEGUM, N., HIGUCHI, M., FUJIMORI, A., UEHARA, Y., NAKAJIMA, T., SUHARA, T., ONO, T. & NENOI, M. 2014. Total body 100-mGy X-irradiation does not induce Alzheimer's disease-like pathogenesis or memory impairment in mice. J Radiat Res, 55, 84-96.
WANG, Y., HALL, R. A., LEE, M., KAMGAR-PARSI, A., BI, X. & BAUDRY, M. 2017. The tyrosine phosphatase PTPN13/FAP-1 links calpain-2, TBI and tau tyrosine phosphorylation. Sci Rep, 7, 11771.
WOLFE, M. S. 2017. Alzheimer's disease II, Switzerland, Springer.
WORLD HEALTH ORGANIZATION. 2017. Dementia [Online]. Available: http://www.who.int/mediacentre/factsheets/fs362/en/ [Accessed 16 december 2017].
WORLD NUCLEAR ASSOCIATION. 2017. What is Radiation? [Online]. Available: http://www.world-nuclear.org/nuclear-basics/what-is-radiation.aspx [Accessed 13 october 2017].
YANG, L., YANG, J., LI, G., LI, Y., WU, R., CHENG, J. & TANG, Y. 2017. Pathophysiological Responses in Rat and Mouse Models of Radiation-Induced Brain Injury. Mol Neurobiol, 54, 1022-1032.
YANKNER, B. A., LU, T. & LOERCH, P. 2008. The aging brain. Annu Rev Pathol, 3, 41-66.
YU, H., HARRISON, F. E. & XIA, F. 2018. Altered DNA repair; an early pathogenic pathway in Alzheimer's disease and obesity. Sci Rep, 8, 5600.
ZAMANIAN, A. & HARDIMAN, C. 2005. Electromagnetic Radiation and Human Health: A Review of Sources and Effects. High Frequency Electronics.
ZHANG, L., Y ANG, H. & TIAN, Y. 2015. Radiation-induced cognitive impairment. Therapeutic Targets for Neurological Diseases.
ZHAO, W. & ROBBINS, M. E. 2009. Inflammation and chronic oxidative stress in radiation-induced late normal tissue injury: therapeutic implications. Curr Med Chem, 16, 130-43.









