Invloed van temperatuur op populatie-dynamiek van Daphnia magna populaties en klonen van verschillende breedtegraad.
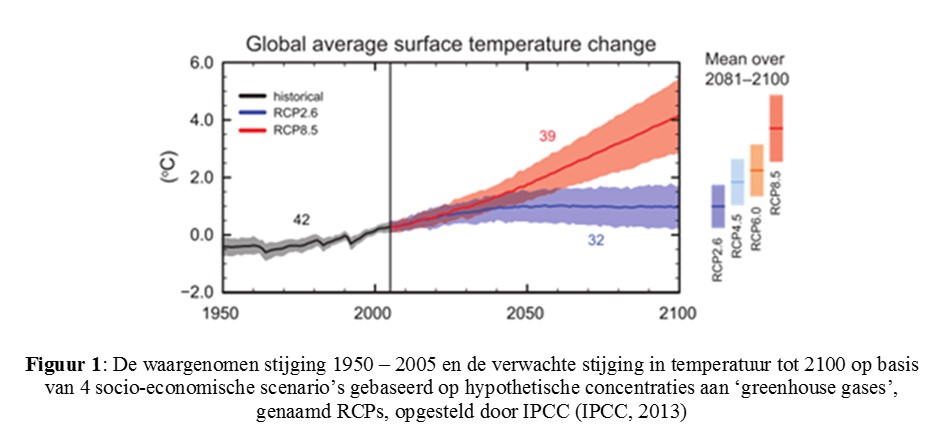
Na alweer een bijzonder warme en droge zomer valt het niet meer te ontkennen: er is een duidelijke tendens van stijgende temperatuur in onze regio, en in de wereld als geheel. Er wordt verwacht dat deze trend zal aanhouden gedurende de komende decennia, zoals beschreven in de rapporten van het Intergovernmental Panel on Climate Change (IPCC 2013) (Fig. 1).
Een stijging in temperatuur beïnvloedt alle ecosystemen en haar bewoners, via een directe invloed van temperatuur op de fysiologie van organismen, bijvoorbeeld de metabolische activiteit van ectothermen (Van Doorslaer et al 2010). Verschuivingen in milieuomstandigheden als gevolg van klimaatverandering dwingen organismen om te reageren. Om extinctie te vermijden, kunnen soorten op drie manieren omgaan met een veranderende omgeving. Ze kunnen zich verplaatsen van hun huidige gebied naar een gebied waar het oorspronkelijk klimaat nu heerst (migratie). Ze kunnen hun gedrag, morfologie, fysiologie,.. aanpassen aan de veranderde condities (fenotypische plasticiteit), alsook hun DNA (genetische adaptatie).
Het is van cruciaal belang om een beter inzicht te krijgen in de respons van soorten op een stijgende temperatuur. Onder meer de fysiologische en evolutionaire responsen alsook de impact van interacties tussen soorten moeten gekwantificeerd worden om voorspellingen omtrent de consequenties van klimaatopwarming accurater te maken (Urban et al. 2016).
De grote watervlo Daphnia magna
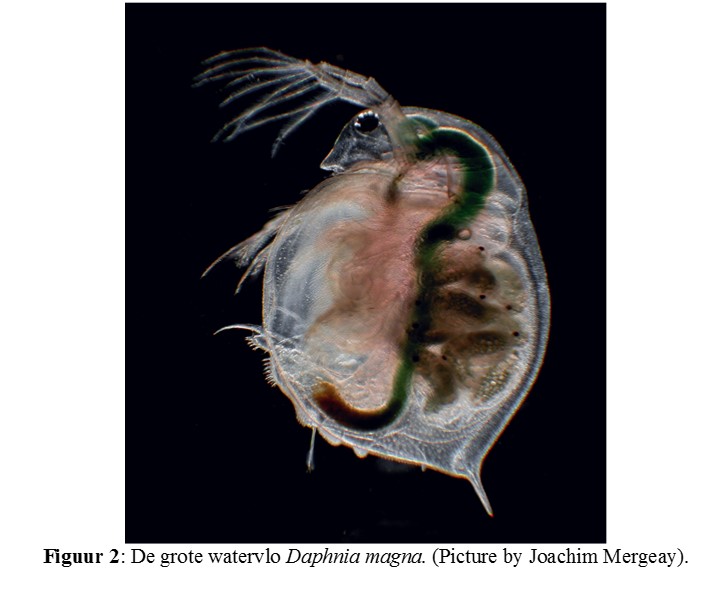
Daphnia magna is de grootste soort Daphnia (maximum 4mm) en de efficiëntste grazer van fytoplankton (Fig. 2). Tegelijk is D. magna ook gevoelig voor predatie door planktivore vis, waardoor deze soort een centrale rol heeft in de ecologie van vijvers en meren (Miner et al 2012). Een voorbeeld van een respons van D. magna op een verhoogde temperatuur is een reductie in hun lichaamslengte, waardoor ze ook minder zichtbaar worden voor planktivore vissen. Effecten van temperatuursverandering op de populatie-densiteit en kenmerken van D. magna zullen dus waarschijnlijk niet enkel deze soort, maar ook geassocieerde soorten beïnvloeden.
Vraagstellingen
We wensten te kwantificeren in welke mate watervlo-populaties van twee verschillende breedtegraden (Noorwegen en België) reageren op verschillende temperaturen. Eerder onderzoek heeft aangetoond dat watervlo-populaties reageren op een verhoging van de temperatuur met 4°C via zowel fenotypische plasticiteit als genetische veranderingen in hun thermale tolerantie (Geerts et al. 2015) als levensgeschiedeniskenmerken (Van Doorslaer et al 2009). We testten volgende hypotheses:
Hypothese 1: Temperatuur heeft een effect op de populatie-aangroei van D. magna populaties uit Noorwegen en België.
Hypothese 2: De respons op temperatuur van D. magna populaties verschilt tussen Noorse en Belgische populaties.
Hypothese 3: Er is klonale variatie voor de respons op temperatuursverandering binnen D. magna populaties.
Algemene onderzoeksstrategie en design van het experiment
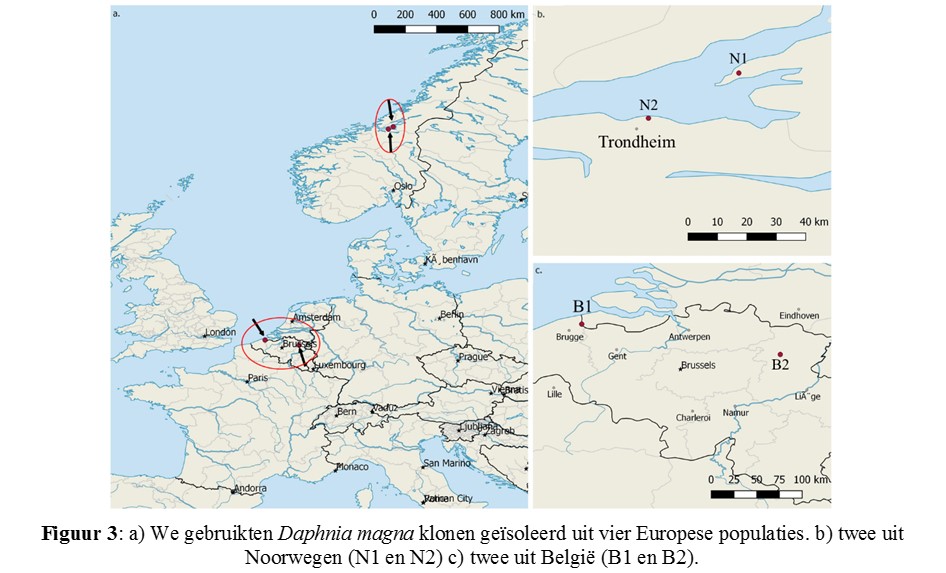
Om onze hypothesen te toetsen stelden we telkens drie klonale lijnen van twee populaties uit België en twee populaties uit Noorwegen (Fig. 3) bloot aan vier temperaturen (14, 18, 22, 26°C). Het gebruik van meerdere klonen per populatie liet toe om naast verschillen tussen populaties, ook verschillen binnen populaties te registreren.
De dieren werden geënt in aquaria en de populatie-densiteit werd om de drie dagen gedurende een periode van 12 weken opgevolgd. Vier populaties x 3 klonen x 4 temperaturen gaf een totaal van 48 aquaria (Fig. 4).

Additioneel verzamelden we waarnemingen over individuen, geïsoleerd in tubes. In elk aquarium werd op die manier elke 3 dagen de individuele overleving, de groei en productie van nakomelingen (zogenaamde “vital rates”) gemeten van twee individuen. De resulterende informatie werd dan gebruikt om continue populatie-modellen op te stellen via Integral Projection Modelling, een relatief nieuwe manier om data te analyseren (Easterling et al. 2000). Integral Projection Modelling stelt modellen op van hoe de kans op overleving, de kans op nakomelingen en de grootte van de nakomelingen geassocieerd is met de lichaamsgrootte van het individu, en hoe die relatie afhankelijk is van de populatie-densiteit. Het resulterende model laat toe te voorspellen hoe populatie-aantallen zullen veranderen doorheen de tijd. Via het model konden we ook detecteren wat de gebruikte strategie is voor elke populatie en kloon. Een voorbeeld van mogelijke strategieën omtrent reproductie zijn dat individuen oftewel vele kleine nakomelingen produceren of slechts enkele grote nakomelingen.
Belgen doen het beter dan de Noren
Het effect van een verhoogde temperatuur verschilde afhankelijk van de populatie, maar gemiddeld over alle populatie-densiteiten resulteerde een hogere temperatuur in een snellere lichaamsgroei, grotere nakomelingen en lagere overleving.
De Noorse en Belgische populaties hadden significant verschillende populatie-densiteiten bij koudere temperaturen (Tukey-HSD, p < 0.005), maar dit verschil verdween bij hogere temperaturen (Fig. 5).
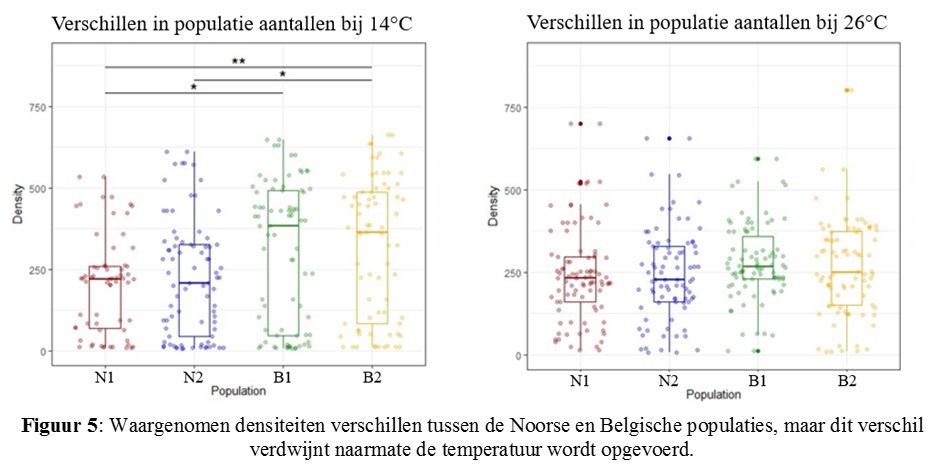
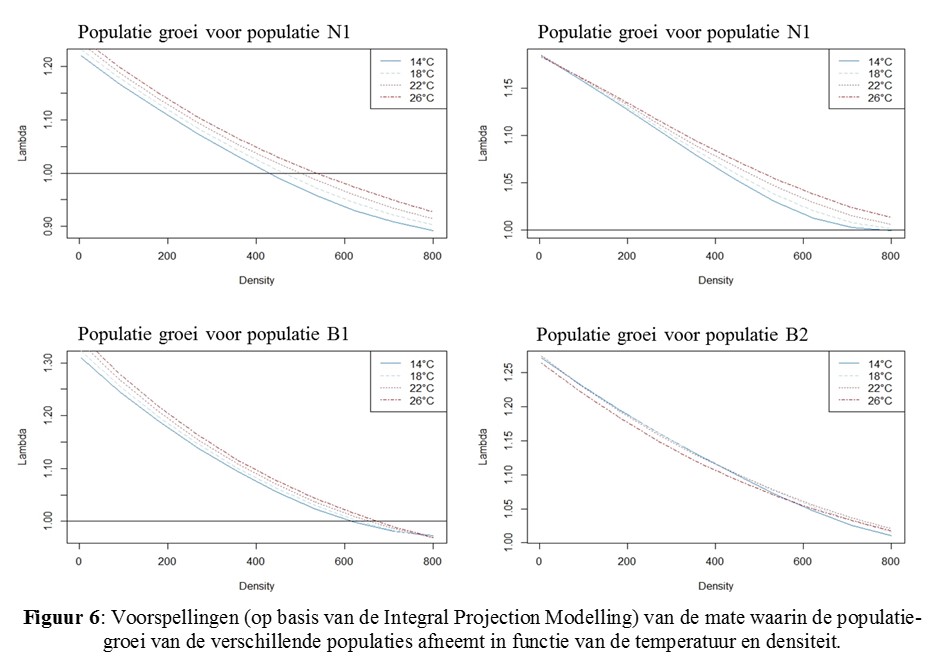
Over het algemeen presteerde de Belgische populaties beter dan de Noorse. Beide Noorse en één Belgische populatie behaalden de hoogste densiteiten bij 26°C (Fig. 6).
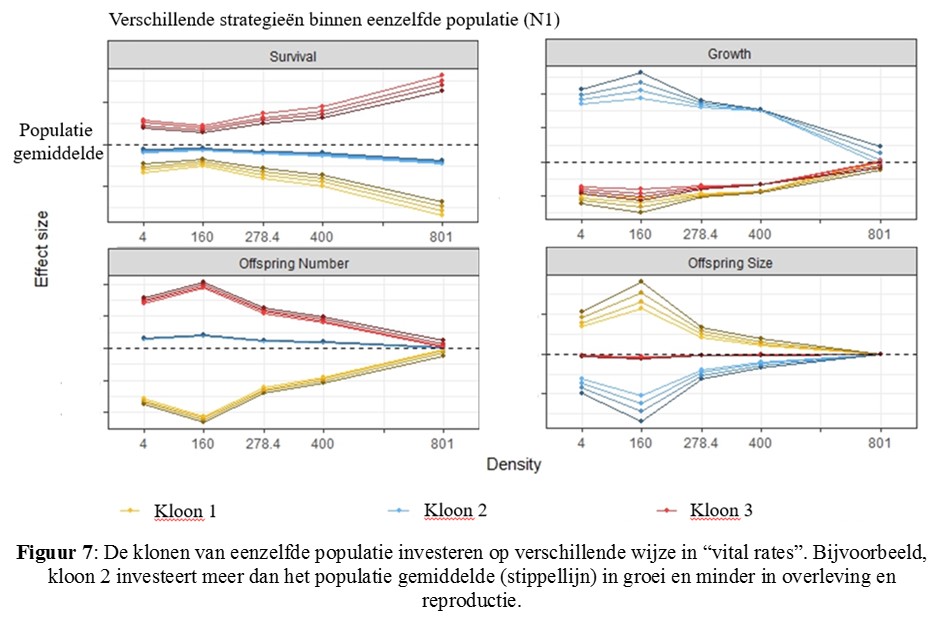
De populaties en hun klonen investeerden op verschillende wijze in de vier gemeten “vital rates” en dus gebruikten ze verschillende strategieën (Fig. 7).
Conclusies en implicaties
We kunnen bevestigen dat de geteste temperaturen een effect hebben op de populatie-aangroei van zowel Noorse als Belgische D. magna populaties (hypothese 1), dat de respons op temperatuur verschilt tussen Noorse en Belgische populaties (hypothese 2), en dat er klonale variatie is voor de respons op temperatuursverandering binnen populaties (hypothese 3). Over het algemeen had temperatuur een positief effect op de populatie-aangroei, maar het patroon was afhankelijk van de populatie (Fig. 6). Voor drie populaties zorgde warmere temperaturen voor hogere populatie-aantallen. We hadden verwacht dat de Noorse populaties beter zouden presteren bij lagere temperaturen, terwijl de Belgische het beter zouden doen bij hogere temperaturen.
De populaties en klonen verschillen in populatie-aangroei en de strategieën. Dit betekent dat er genetische variatie is voor de betrokken eigenschappen en dus potentieel voor evolutie. Er is dus klonale variatie, maar geen echt terugkerend patroon van differentiële evolutie tussen de populaties.
De analyse van populatie-dynamiek op basis van Integral Projection Modelling is een belangrijke stap verder dan klassieke levenstabel-analyses, die ons beter toelaat de complexiteit van responsen op klimaatsverandering te bestuderen. Het is noodzakelijk dat de klimaatsverandering en al zijn gevolgen worden onderzocht, want zoals de UN Secretaris Generaal, Ban Ki-moon zei in 2014: "There is no plan B for climate action, because there is no planet B."
Bibliografie
Referenties
-
Alekseev, V., & Lampert, W. (2001). Maternal control of resting-egg production in Daphnia. Nature, 414, 899–901. http://doi.org/10.1038/414899a
-
Alley, R. B., Marotzke, J., Nordhaus, W. D., Overpeck, J. T., Peteet, D. M., Pielke, R. A., … Wallace, J. M. (2003). Abrupt Climate Change. Science, 299, 2005–2010.
- Anderson, J. T., Panetta, A. M., & Mitchell-Olds, T. (2012). Evolutionary and Ecological Responses to Anthropogenic Climate Change. Plant Physiology, 160, 1728–1740. http://doi.org/10.1104/pp.112.206219
- Atkinson, D. (1994). Temperature and organism size – a biological law for ectotherms? Advanced in Ecological Research, 25, 1–58. http://doi.org/10.1016/S0306-4565(99)00015-7
- Barnett, T. P., Adam, J. C., & Lettenmaier, D. P. (2005). Potential impacts of a warming climate on water availability in snow-dominated regions. Nature, 438, 303–309.
- Bates, D., Mächler, M., Bolker, B., & Walker, S. (2015). Fitting Linear Mixed-Effects Models Using lme4. Journal of Statistical Software, 67(1), 1–48. http://doi.org/10.18637/jss.v067.i01
- Bauder, E. T. (2005). The effects of an unpredictable precipitation regime on vernal pool hydrology. Freshwater Biology, 50, 2129–2135. http://doi.org/10.1111/j.1365-2427.2005.01471.x
- Beerling, D. J., & Royer, D. L. (2011). Convergent Cenozoic CO2 history. Nature Geoscience, 4(7), 418–420. http://doi.org/10.1038/ngeo1186
- Blois, J. L., Williams, J. W., Fitzpatrick, M. C., Jackson, S. T., & Ferrier, S. (2013). Space can substitute for time in predicting climate-change effects on biodiversity. Proceedings of the National Academy of Sciences, 110(23), 9374–9379. http://doi.org/10.1073/pnas.1220228110
- Boersma, M., De Meester, L., & Spaak, P. (1999). Environmental stress and local adaptation in Daphnia magna. Limnology and Oceanography, 44(2), 393–402. http://doi.org/10.4319/lo.1999.44.2.0393
- Boeye, J., Travis, J. M. J., Stoks, R., & Bonte, D. (2013). More rapid climate change promotes evolutionary rescue through selection for increased dispersal distance. Evolutionary Applications, 6, 353–364. http://doi.org/10.1111/eva.12004
- Bruijning, M., Visser, M. D., Hallmann, C. A., & Jongejans, E. (2018). Trackdem: Automated particle tracking to obtain population counts and size distributions from videos in R. Methods in Ecology and Evolution, 1–9. http://doi.org/10.1111/2041-210X.12975
- Burns, C. W. (2000). Crowding-induced changes in growth, reproduction and morphology of Daphnia. Freshwater Biology, 43, 19–29. http://doi.org/10.1046/j.1365-2427.2000.00510.x
- Caceres, C. E. (1998). Interspecific Variation in the Abundance, Production, and Emergence of Daphnia Diapausing Eggs. Ecology, 79(5), 1699–1710.
- Carvalho, G. R. (1987). The Clonal Ecology of Daphnia magna (Crustacea: Cladocera): II. Thermal Differentiation among Seasonal Clones. Journal of Animal Ecology, 56(2), 469–478.
- Charmantier, A., Mccleery, R. H., Cole, L. R., Perrins, C., Kruuk, L. E. B., & Sheldon, B. C. (2008). Adaptive Phenotypic Plasticity in Response to Climate Change in a Wild Bird Population. Science, 320, 800–803. http://doi.org/10.1126/science.1157174
- Chen, D., & Chen, H. W. (2013). Using the Köppen classification to quantify climate variation and change: An example for 1901-2010. Environmental Development, 6, 69–79. http://doi.org/10.1016/j.envdev.2013.03.007
- Chen, I., Hill, J. K., Ohlemüller, R., Roy, D. B., & Thomas, C. D. (2011). Rapid Range Shifts of Species of Climate Warming. Science, 333, 1024–1026.
- Chen, M., Chen, F., Li, J., & Zhao, B. (2009). Effect of Temperature and Food on Development and Growth of Daphnia similoides (Cladocera: Daphniidae) from Lake Donghu. Journal of Freshwater Ecology, 24(4), 545–551. http://doi.org/10.1080/02705060.2009.9664331
- Childs, D. Z., Rees, M., Rose, K. E., Grubb, P. J., & Ellner, S. P. (2003). Evolution of complex flowering strategies: an age- and size-structured integral projection model. Proceedings of the Royal Society B: Biological Sciences, 270, 1829–1838. http://doi.org/10.1098/rspb.2003.2399
- Chopelet, J., Blier, P. U., & Dufresne, F. (2008). Plasticity of Growth Rate and Metabolism in Daphnia magna Populations From Different Thermal Habitats. Journal of Experimental Zoology, 309A(June), 553–562. http://doi.org/10.1002/jez.488
- Ciais, P., Sabine, C., Bala, G., Bopp, L., Brovkin, V., Canadell, J., … Thornton, P. (2013). Climate Change 2013: The physical science basis. Contribution of working group I to the fifth assessment report of the Intergovernmental Panel on Climate Change. Cambrigde University Press, 465–570. http://doi.org/10.1017/CBO9781107415324.015
- Costanza, R., D’Arge, R., de Groot, R., Farber, S., Grasso, M., Hannon, B., … van den Belt, M. (1998). The value of the world’s ecosystem services and natural capital. Nature, 387(6630), 253–260. http://doi.org/10.1038/387253a0
- Coulson, T. (2012). Integral projections models, their construction and use in posing hypotheses in ecology. Oikos, 121, 1337–1350. http://doi.org/10.1111/j.1600-0706.2012.00035.x
- Coulson, T., Macnulty, D. R., Stahler, D. R., Wayne, R. K., & Smith, D. W. (2011). Modeling Effects of Environmental Change on Wolf Population Dynamics Trait Evolution, and Life History. Science, 334(December), 1275–1279.
- Coulson, T., Tuljapurkar, S., & Childs, D. Z. (2010). Using evolutionary demography to link life history theory, quantitative genetics and population ecology. Journal of Animal Ecology, 79, 1226–1240. http://doi.org/10.1111/j.1365-2656.2010.01734.x
- Cousyn, C., De Meester, L., Colbourne, J. K., Brendonck, L., Verschuren, D., & Volckaert, F. (2001). Rapid, local adaptation of zooplankton behavior to changes in predation pressure in the absence of neutral genetic changes. Proceedings of the National Academy of Sciences, 98(11), 6256–6260. http://doi.org/10.1073/pnas.111606798
- De Meester, L., Declerck, S., Stoks, R., Louette, G., Van De Meutter, F., De Bie, T., … Brendonck, L. (2005). Ponds and pools as model systems in conservation biology, ecology and evolutionary biology. Aquatic Conservation: Marine and Freshwater Ecosystems, 15(6), 715–725. http://doi.org/10.1002/aqc.748
- De Meester, L., Van Doorslaer, W., Geerts, A. N., Orsini, L., & Stoks, R. (2011). Thermal Genetic Adaptation in the Water Flea Daphnia and its Impact: An Evolving Metacommunity Approach. Integrative and Comparative Biology, 51(5), 703–718. http://doi.org/10.1093/icb/icr027
- DeWitt, T. J., Sih, A., & Sloan Wilson, D. (1998). Costs and limits of phenotypic plasticity. Tree, 13(2), 77–81.
- Dudgeon, D., Arthington, A. H., Gessner, M. O., Kawabata, Z.-I., Knowler, D. J., Lévêque, C., … Sullivan, C. A. (2006). Freshwater biodiversity: importance, threats, status and conservation challenges. Biological Reviews, 81, 163–182. http://doi.org/10.1017/S1464793105006950
- Durner, G. M., Douglas, D. C., Nielson, R. M., Amstrup, S. C., McDonald, T. L., Stirling, I., … Derocher, A. E. (2009). Predicting 21st-century polar bear habitat distribution from global climate models. Ecological Monographs, 79(1), 25–58.
- Easterling, M. R., Ellner, S. P., & Dixon, P. M. (2000). Size-Specific Sensitivity: Applying a New Structured Population Model. Ecology, 81, 694–708.
- Elgar, M. A. (1990). Evolutionary Compromise between a Few Large and Many Small Eggs: Comparative Evidence in Teleost Fish. Oikos, 59(2), 283–287.
- Ellner, S. P., & Rees, M. (2006). Integral Projection Models for Species with Complex Demography. The American Naturalist, 167(3), 410–428. http://doi.org/10.1086/499438
- Fields, P. D., Reisser, C., Dukic, M., Haag, C. R., & Ebert, D. (2015). Genes mirror geography in Daphnia magna. Molecular Ecology, 24, 4521–4536. http://doi.org/10.1111/mec.13324
- Frankham, R. (1996). Relationship of Genetic Variation to Population Size in Wildlife. Conservation Biology, 10(6), 1500–1508. http://doi.org/10.1046/j.1523-1739.1996.10061500.x
- Franks, S. J., & Hoffmann, A. A. (2012). Genetics of Climate Change Adaptation. Annual Review of Genetics, 46(1), 185–208. http://doi.org/10.1146/annurev-genet-110711-155511
- Geerts, A. N., De Meester, L., & Stoks, R. (2014). Heat tolerance and its evolutionary potential along a latitudinal gradient in Daphnia magna . Evolutionary Ecology Research, 16, 517–528.
- Geerts, A. N., Vanoverbeke, J., Vanschoenwinkel, B., Van Doorslaer, W., Feuchtmayr, H., Atkinson, D., … De Meester, L. (2015). Rapid evolution of thermal tolerance in the water flea Daphnia. Nature Climate Change, 5, 665–668. http://doi.org/10.1038/nclimate2628
- Gergs, A., Preuss, T. G., & Palmqvist, A. (2014). Double Trouble at High Density: Cross-Level Test of Resource-Related Adaptive Plasticity and Crowding-Related Fitness. PLoS ONE, 9(3), 1–13. http://doi.org/10.1371/journal.pone.0091503
- Giebelhausen, B., & Lampert, W. (2001). Temperature reaction norms of Daphnia magna: the effect of food concentration. Freshwater Biology, 46, 281–289. http://doi.org/10.1046/j.1365-2427.2001.00630.x
- Gienapp, P., Teplitsky, C., Alho, J. S., Mills, J. A., & Merilä, J. (2008). Climate change and evolution : disentangling environmental and genetic responses. Molecular Ecology, 17, 167–178. http://doi.org/10.1111/j.1365-294X.2007.03413.x
- Glazier, D. S. (1992). Effects of Food, Genotype, and Maternal Size and Age on Offspring Investment in Daphnia Magna . Ecology, 73(3), 910–926.
- Gorham, E. (1991). Northern Peatlands : Role in the Carbon Cycle and Probable Responses to Climatic Warming. Ecological Applications, 1(2), 182–195.
- Guisande, C. (1993). Reproductive strategy as population density varies in Daphnia magna (Cladocera). Freshwater Biology, 29(3), 463–467.
- Gynther, I., Waller, N., & Leung, L. K.-P. (2016). Confirmation of the extinction of the Bramble Cay melomys Melomys rubicola on Bramble Cay, Torres Strait: results and conclusions from a comprehensive survey in August–September 2014. Unpublished Report to the Department of Environment and Heritage Protection, Queensland Government, Brisbane.
- Hairston, N. G., & De Meester, L. (2008). Daphnia Paleogenetics and Environmental Change: Deconstructing the Evolution of Plasticity. International Revue Hydrobiology, 93, 578–592. http://doi.org/10.1002/iroh.200811057
- Harris, K. D. M., Bartlett, N. J., & Lloyd, V. K. (2012). Daphnia as an Emerging Epigenetic Model Organism. Genetics Research International, 2012, 1–8. http://doi.org/10.1155/2012/147892
- Heugens, E. H. W., Tokkie, L. T. B., Kraak, M. H. S., Hendriks, A. J., Van Straalen, N. M., & Admiraal, W. (2006). Population growth of Daphnia magna under multiple stress conditions: Joint effects of Temperature, Food, and Cadmium. Environmental Toxicology and Chemistry, 25(5), 1399–1407. http://doi.org/10.1897/05-294R.1
- Hoffmann, A. A., & Sgro, C. M. (2011). Climate change and evolutionary adaptation. Nature, 470, 479–485. http://doi.org/10.1038/nature09670
- Holt, R. D. (1990). The microevolutionary consequences of climate change. Trends in Ecology and Evolution, 5(9), 311–315. http://doi.org/10.1016/0169-5347(90)90088-U
- IPCC. (2013). Summary for Policymakers. In: Climate Change 2013: The Physical Science Basis. Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change [Stocker, T.F., D. Qin, G.-K. Plattner, M. Tignor, S.K. Allen, J. Boschung, A. Nauels, Y. Xia, V. Bex and P.M. Midgley (eds.)]. Cambridge University Press, Cambridge,United Kingdom and New York, NY, USA. http://doi.org/10.1017/CBO9781107415324.004
- IPCC. (2014). Climate Change 2014: Synthesis report. Contribution of Working Groups I, II and III to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change [Core Writing Team, R.K. Pachauri and L.A. Meyer (eds.)]. IPCC, Geneva, Switzerland, 151pp. http://doi.org/10.1017/CBO9781107415324
- Jacquemyn, H., Brys, R., & Jongejans, E. (2010). Size-dependent flowering and costs of reproduction affect population dynamics in a tuberous perennial woodland orchid. Journal of Ecology, 98(5), 1204–1215. http://doi.org/10.1111/j.1365-2745.2010.01697.x
- Jansen, M., De Meester, L., Cielen, A., Buser, C. C., & Stoks, R. (2011). The interplay of past and current stress exposure on the water flea Daphnia. Functional Ecology, 25, 974–982. http://doi.org/10.1111/j.1365-2435.2011.01869.x
- Jansen, M., Geerts, A. N., Rago, A., Spanier, K. I., Denis, C., De Meester, L., & Orsini, L. (2017). Thermal tolerance in the keystone species Daphnia magna—a candidate gene and an outlier analysis approach. Molecular Ecology, 26, 2291–2305. http://doi.org/10.1111/mec.14040
- Janssens, L., Dinh Van, K., Debecker, S., Bervoets, L., & Stoks, R. (2014). Local adaptation and the potential effects of a contaminant on predator avoidance and antipredator responses under global warming: A space-for-time substitution approach. Evolutionary Applications, 7(3), 421–430. http://doi.org/10.1111/eva.12141
- Jones, C. G., Lawton, J. H., & Shachak, M. (1994). Organisms as ecosystem engineers. Oikos, 69(3), 373–386. http://doi.org/10.2307/3545850
- Jongejans, E., Van Benthem, K. J., & Bruijning, M. (2017). Disentangling evolutionary , plastic and demographic processes underlying trait dynamics: a review of four frameworks. Methods in Ecology and Evolution, 8, 75–85. http://doi.org/10.1111/2041-210X.12627
- Kottek, M., Grieser, J., Beck, C., Rudolf, B., & Rubel, F. (2006). World map of the Köppen-Geiger climate classification updated. Meteorologische Zeitschrift, 15(3), 259–263. http://doi.org/10.1127/0941-2948/2006/0130
- Lack, D. (1947). The Significance of Clutch-size. Ibis, 89, 302–352. http://doi.org/10.1111/j.1474-919X.1947.tb04155.x
- Lampert, W. (2006). Daphnia: Model herbivore, predator and prey. Polish Journal of Ecology, 54(4), 607–620.
- Law, R. (1979). Optimal Life Histories Under Age-Specific Predation. The American Naturalist, 114(3), 399–417. http://doi.org/10.1086/283488
- Lawrence, D. M., & Slater, A. G. (2005). A projection of severe near-surface permafrost degradation during the 21st century. Geophysical Research Letters, 32, 1–5. http://doi.org/10.1029/2005GL025080
- Lika, K., & Kooijman, S. A. L. M. (2003). Life History Implications of Allocation to Growth Versus Reproduction in Dynamic Energy Budgets. Bulletin of Mathematical Biology, 65, 809–834. http://doi.org/10.1016/S0092-8240(03)00039-9
- Martínez-Jerónimo, F. (2012). Description of the individual growth of Daphnia magna (Crustacea: Cladocera) through the von Bertalanffy growth equation. Effect of photoperiod and temperature. Limnology, 13, 65–71. http://doi.org/10.1007/s10201-011-0356-2
- Mckee, D., & Ebert, D. (1996). The interactive effects of temperature, food level and maternal phenotype on offspring size in Daphnia magna. Oecologia, 107, 189–196. http://doi.org/10.1007/BF00327902
- Merilä, J., & Hendry, A. P. (2014). Climate change, adaptation, and phenotypic plasticity: The problem and the evidence. Evolutionary Applications, 7(1), 1–14. http://doi.org/10.1111/eva.12137
- Merow, C., Dahlgren, J. P., Metcalf, C. J. E., Childs, D. Z., Evans, M. E. K., Jongejans, E., … Mcmahon, S. M. (2014). Advancing population ecology with integral projection models: A practical guide. Methods in Ecology and Evolution, 5, 99–110. http://doi.org/10.1111/2041-210X.12146
- Merow, C., Latimer, A. M., Wilson, A. M., Mcmahon, S. M., Rebelo, A. G., & Silander, J. A. (2014). On using integral projection models to generate demographically driven predictions of species’ distributions: Development and validation using sparse data. Ecography, 37(12), 1167–1183. http://doi.org/10.1111/ecog.00839
- Metcalf, C. J. E., McMahon, S. M., Salguero-Gomez, R., & Jongejans, E. (2013). IPMpack: An R package for integral projection models. Methods in Ecology and Evolution, 4, 195–200. http://doi.org/10.1111/2041-210x.12001
- Mimura, N. (2013). Sea-level rise caused by climate change and its implications for society. Proceedings of the Japan Academy Series B-Physical and Biological Sciences, 89, 281–301. http://doi.org/10.2183/pjab.89.281
- Miner, B. E., De Meester, L., Pfrender, M. E., Lampert, W., & Hairston, N. G. (2012). Linking genes to communities and ecosystems: Daphnia as an ecogenomic model. Proceedings of the Royal Society B: Biological Sciences, 279(1735), 1873–1882. http://doi.org/10.1098/rspb.2011.2404
- Mitchell, S. E., & Lampert, W. (2000). Temperature adaptation in a geographically widespread zooplankter, Daphnia magna. Journal of Evolutionary Biology, 13(3), 371–382. http://doi.org/10.1046/j.1420-9101.2000.00193.x
- Mittmann, B., Ungerer, P., Klann, M., Stollewerk, A., & Wolff, C. (2014). Development and staging of the water flea Daphnia magna (Straus, 1820; Cladocera, Daphniidae) based on morphological landmarks. EvoDevo, 5(12), 1–19. http://doi.org/10.1186/2041-9139-5-12
- Moline, M. A., Karnovsky, N. J., Brown, Z., Divoky, G. J., Frazer, T. K., Jacoby, C. A., … Fraser, W. R. (2008). High Latitude Changes in Ice Dynamics and Their Impact on Polar Marine Ecosystems. Annals of the New York Academy of Sciences, 1134, 267–319. http://doi.org/10.1196/annals.1439.010
- Moritz, C., Patton, J. L., Conroy, C. J., Parra, J. L., White, G. C., & Beissinger, S. R. (2008). Impact of a century of climate change on small-mammal communities in Yosemite National Park, USA. Science, 322, 261–264.
- Naumann, E. (1934). Uber die Anwendung von Daphnia magna Straus als Versuchstier zur experimentellen Klarlegung der Lebensverhältnisse im Wasser. Internationale Revue Der Gesamten Hydrobiologie Und Hydrographie, 31, 421–431. http://doi.org/10.1002/iroh.19340310126
- Neuwald, J. L., & Valenzuela, N. (2011). The lesser known challenge of climate change: Thermal variance and Sex-reversal in Vertebrates with Temperature-Dependent Sex Determination. PLoS ONE, 6(3), 1–9. http://doi.org/10.1371/journal.pone.0018117
- Nunney, L. (2016). Adapting to a changing environment: Modeling the interaction of directional selection and plasticity. Journal of Heredity, 107(1), 15–24. http://doi.org/10.1093/jhered/esv084
- Oertli, B., Céréghino, R., Hull, A., & Miracle, R. (2009). Pond conservation: From science to practice. Hydrobiologia, 634, 1–9. http://doi.org/10.1007/s10750-009-9891-9
- Paul, R. J., Mertenskötter, A., Pinkhaus, O., Pirow, R., Gigengack, U., Buchen, I., … Zeis, B. (2012). Seasonal and interannual changes in water temperature affect the genetic structure of a Daphnia assemblage (D. longispina complex) through genotype-specific thermal tolerances. Limnology and Oceanography, 57(2), 619–633. http://doi.org/10.4319/lo.2012.57.2.0619
- Peel, M. C., Finlayson, B. L., & McMahon, T. A. (2007). Updated World Map of the Köppen-Geiger Climate Classification. Hydrology and Earth System Sciences, 11(5), 1633–1644. http://doi.org/10.5194/hess-11-1633-2007
- Pickett, S. T. A. (1989). Space-for-Time Substitution as an Alternative to Long-Term Studies. In Long-Term Studies in Ecology. Approaches and Alternatives (pp. 110–135). http://doi.org/10.1007/978-1-4615-7358-6
- Post, E., Langvatn, R., Forchhammer, M. C., & Stenseth, N. C. (1999). Environmental variation shapes sexual dimorphism in red deer. Proceedings of the National Academy of Sciences of the United States of America, 96, 4467–4471. http://doi.org/10.1073/PNAS.96.8.4467
- Pounds, J. A., Fogden, M. P. L., & Campbell, J. H. (1999). Biological response to climate change on a tropical mountain. Nature, 398(April), 611–615.
- Pritchard, H. D., Arthern, R. J., Vaughan, D. G., & Edwards, L. A. (2009). Extensive dynamic thinning on the margins of the Greenland and Antarctic ice sheets. Nature, 461, 971–977.
- Rees, M., Childs, D. Z., & Ellner, S. P. (2014). Building integral projection models: A user’s guide. Journal of Animal Ecology, 83, 528–545. http://doi.org/10.1111/1365-2656.12178
- Rubel, F., Brugger, K., Haslinger, K., & Auer, I. (2017). The climate of the European Alps: Shift of very high resolution Köppen-Geiger climate zones 1800-2100. Meteorologische Zeitschrift, 26(2), 115–125. http://doi.org/10.1127/metz/2016/0816
- Salguero-Gomez, R., Siewert, W., Casper, B. B., & Tielborger, K. (2012). A demographic approach to study effects of climate change in desert plants. Philosophical Transactions of the Royal Society B: Biological Sciences, 367, 3100–3114. http://doi.org/10.1098/rstb.2012.0074
- Scheffer, M., Carpenter, S., Foley, J. A., Folke, C., & Walker, B. H. (2001). Catastrophic shifts in ecosystems. Nature, 413, 591–596.
- Scheffer, M., Hosper, S., Meijer, M., Moss, B., & Jeppesen, E. (1993). Alternative equilibria in shalow lakes. Trends in Ecology and Evolution, 8(8), 275–279. http://doi.org/10.1016/0169-5347(93)90254-M.
- Scheffers, B., De Meester, L., Bridge, T., Hoffmann, A. A., Pandolfi, J. M., Corlett, R. T., … Watson, J. E. M. (2016). The broad footprint of climate change from genes to biomes to people. Science, 354(6313), 719–731. http://doi.org/10.1126/science.aaf7671
- Scheiner, S. M. (1993). Genetics and Evolution of Phenotypic Plasticity. Annual Review of Ecology and Systematics, 24, 35–68.
- Scheiner, S. M., & Berrigan, D. (1998). THE GENETICS OF PHENOTYPIC PLASTICITY . VIII . THE COST OF PLASTICITY IN DAPHNIA PULEX. Evolution, 52(2), 368–378.
- Sinervo, B., & Licht, P. (1991). Proximate Constraints on the Evolution of Egg Size, Number, and Total Clutch Mass in Lizards. Science, 252(5010), 1300–1302. http://doi.org/10.1126/science.252.5010.1300
- Solomon, S., Plattner, G.-K., Knutti, R., & Friedlingstein, P. (2009). Irreversible climate change due to carbon dioxide emissions. Proceedings of the National Academy of Sciences of the United States of America, 106(6), 1704–1709.
- Stoks, R., Geerts, A. N., & De Meester, L. (2014). Evolutionary and plastic responses of freshwater invertebrates to climate change: realized patterns and future potential. Evolutionary Applications, 7, 42–55. http://doi.org/10.1111/eva.12108
- Stoks, R., Govaert, L., Pauwels, K., Jansen, B., & De Meester, L. (2016). Resurrecting complexity: The interplay of plasticity and rapid evolution in the multiple trait response to strong changes in predation pressure in the water flea Daphnia magna. Ecology Letters, 19, 180–190. http://doi.org/10.1111/ele.12551
- Stubben, C., & Milligan, B. (2007). Estimating and Analyzing Demographic Models using the popbio Package in R. Journal Of Statistical Software, 22(11), 1–23. http://doi.org/10.18637/jss.v022.i11
- Thomas, C. D., Cameron, A., Green, R. E., Bakkenes, M., Beaumont, L. J., Collingham, Y. C., … Williams, S. E. (2004). Extinction risk from climate change. Nature, 427(January), 145–148. http://doi.org/10.1038/nature02121
- Trubetskova, I., & Lampert, W. (1995). Egg size and egg mass of Daphnia magna: response to food availability. Hydrobiologia, 307, 139–145. http://doi.org/10.1007/BF00032005
- Van Buskirk, J., & Steiner, U. K. (2009). The fitness costs of developmental canalization and plasticity. Journal of Evolutionary Biology, 22, 852–860. http://doi.org/10.1111/j.1420-9101.2009.01685.x
- Van Doorslaer, W., Stoks, R., Duvivier, C., Bednarska, A., & De Meester, L. (2009). POPULATION DYNAMICS DETERMINE GENETIC ADAPTATION TO TEMPERATURE IN DAPHNIA. Evolution, 63(7), 1867–1878. http://doi.org/10.1111/j.1558-5646.2009.00679.x
- Van Doorslaer, W., Stoks, R., Swillen, I., Feuchtmayr, H., Atkinson, D., Moss, B., & De Meester, L. (2010). Experimental thermal microevolution in community-embedded Daphnia populations. Climate Research, 43, 81–89. http://doi.org/10.3354/cr00894
- Vandegehuchte, M. B., Kyndt, T., Vanholme, B., Haegeman, A., Gheysen, G., & Janssen, C. R. (2009). Occurrence of DNA methylation in Daphnia magna and influence of multigeneration Cd exposure. Environment International, 35(4), 700–706. http://doi.org/10.1016/j.envint.2009.01.002
- Vindenes, Y., Edeline, E., Ohlberger, J., Langangen, Ø., Winfield, I. J., Stenseth, N. C., & Vøllestad, L. A. (2014). Effects of Climate Change on Trait-Based Dynamics of a Top Predator in Freshwater Ecosystems. The American Naturalist, 183(2), 243–256. http://doi.org/10.1086/674610
- Vitousek, P. M., Mooney, H. A., Lubchenco, J., & Melillo, J. M. (1997). Human Domination of Earth’s Ecosystems. Science, 277(5325), 494–499. http://doi.org/10.1126/science.277.5325.494
- Vizoso, D. B. (2013). Daphnia magna Life Cycle. Retrieved from https://commons.wikimedia.org/wiki/File:DaphniaMagna_LifeCycle_DVizoso…
- Walsh, M. R. (2013). The Link Between Environmental Variation and Evolutionary Shifts in Dormancy in Zooplankton. Integrative and Comparative Biology, 53(4), 713–722. http://doi.org/10.1093/icb/ict035
- Wellborn, G. A., Skelly, D. K., & Werner, E. E. (1996). Mechanisms Creating Community Structure Across a Freshwater Habitat Gradient. Annual Review of Ecology and Systematics, 27, 337–363. http://doi.org/10.1146/annurev.ecolsys.27.1.337
- Welsh, D. M. (1970). Substitution of Space for Time in a Stufy of Slope Development. The Journal of Geology, 78(2), 234–239. http://doi.org/10.1007/sl0754-009-9070-6
- West-Eberhard, M. J. (1989). Phenotypic Plasticity and the Origins of Diversity. Annual Review of Ecology and Systematics, 20, 249–278.
- Wickham, H. (2009). ggplot2: Elegant Graphics for Data Analysis. New York: Springer-Verlag. Retrieved from http://ggplot2.org
- Wojtal-Frankiewicz, A. (2012). The effects of global warming on Daphnia spp. population dynamics: A review. Aquatic Ecology, 46, 37–53. http://doi.org/10.1007/s10452-011-9380-x
- Yampolsky, L. Y., Schaer, T. M. M., & Ebert, D. (2014a). Adaptive phenotypic plasticity and local adaptation for temperature tolerance in freshwater zooplankton. Proceedings of the Royal Society B: Biological Sciences, 281(20132744).
- Yampolsky, L. Y., Zeng, E., Lopez, J., Williams, P. J., Dick, K. B., Colbourne, J. K., & Pfrender, M. E. (2014b). Functional genomics of acclimation and adaptation in response to thermal stress in Daphnia. BMC Genomics, 15(859), 1–12.
- Yule, K. M., Miller, T. E. X., & Rudgers, J. A. (2013). Costs, benefits, and loss of vertically transmitted symbionts affect host population dynamics. Oikos, 122, 1512–1520. http://doi.org/10.1111/j.1600-0706.2012.00229.x