Nood aan nieuwe therapeutische strategieën voor Multipele Systeem Atrofie
““Met mij gaat het zo goed mogelijk”, dat antwoordde ik enkele weken geleden op de vraag van de neuroloog hoe het nu met mij was. Ik vermoedde dat hij dacht: ofwel is die patiënt een echte optimist ofwel verzwijgt hij zijn werkelijke toestand; ik zou hem alsdan geantwoord hebben: “Geen van beide dokter, geen optimist wel realist. Ik weet maar al te goed welke erge ziekte ik heb, doch ik heb al enkele jaren de gevolgen ervan min of meer aanvaard.” - Rob, MSA-patiënt.
MSA? Nog nooit van gehoord!
Multipele Systeem Atrofie, of MSA in het kort, is een progressieve hersenziekte die voornamelijk in de oudere populatie voorkomt. Het is een redelijk zeldzame ziekte, die slechts 2 à 4 personen op 100.000 treft. Er bestaan drie soorten ziekteverschijnselen van MSA die een verschillend ziektebeeld met zich meebrengen. Allereerst is er de parkinsoniaanse variant (MSA-P), die enkele van de typische symptomen van de ziekte van Parkinson (spierstijfheid en motorische beperkingen) met zich meebrengt. Daarnaast bestaat er ook een cerebellaire vorm (MSA-C), die de kleine hersenen (het cerebellum) treffen. Hierdoor ontstaan stoornissen in de coördinatie van bewegingen (ataxie). Als laatste kan ook het autonome zenuwstelsel aangetast zijn, met als gevolg problemen met urine ophouden, bloeddruk die snel afzwakt en zo kan leiden tot flauwvallen, enzovoort.
“Het is verdomd moeilijk MSA te onderscheiden van andere hersenziekten, zelfs voor ervaren neurologen: er zal altijd een schemerzone zijn zeker met Parkinson, mijn neuroloog twijfelde tussen beide bij de eerste consultatie in 2003, maar 14 dagen later had hij het juist; de stelregel in algemene zin is dat als Parkinson medicatie niet aanslaat, het meestal gaat om een andere hersenziekte dus ook MSA. Toch is het verschil niet altijd zo eenvoudig vast te stellen: mijn ervaringen met lotgenoten leren mij dat soms wekenlange opnamen in een kliniek nodig zijn.” – Rob, MSA-patiënt
MSA behoort tot de groep van de α-synucleïnopathieën, samen met de ziekte van Parkinson en dementie met Lewy-inclusielichaampjes (DLB). De oorzaak is telkens de aanwezigheid van α-synucleïne (een eiwit) bevattende eiwitophopingen. De symptomen van deze aandoeningen verschillen slechts op een paar elementen van elkaar, waardoor een juiste diagnose vaak moeilijk wordt.
Wat zijn de onderliggende ziektemechanismen bij MSA?
De symptomen bij MSA worden uitgelokt doordat neuronen zullen afsterven (“atrofie”) en dit kan voorkomen in meerdere delen van de hersenen (“multipele systeem”). Deze afbraak wordt veroorzaakt door de aanwezigheid van α-synucleïne bevattende eiwitophopingen, genaamd Lewy-inclusielichaampjes. Deze komen bij MSA voor in de ondersteunende hersencellen (oligodendrocyten). In normale omstandigheden staan deze oligodendrocyten in voor de productie van myeline, wat een isolerende laag rondom de neuronen vormt. Hierdoor wordt de geleiding van zenuwprikkels in de hersenen versterkt. Anderzijds staan deze cellen ook in voor de productie van trofische stoffen, die ervoor zorgen dat de omliggende neuronen kunnen overleven en goed kunnen functioneren. Bij MSA-patiënten is de functie van de oligodendrocyten verstoord doordat deze Lewy-inclusielichaampjes de normale cellulaire processen hinderen. Dit belemmert enerzijds de productie van de isolerende myelinelaag. Anderzijds zullen de oligodendrocyten onvoldoende trofische stoffen produceren, waardoor de naburige neuronen uiteindelijk zullen afsterven.
Dit wordt geïllustreerd in onderstaande afbeelding. De gele cel is een ondersteunende oligodendrocyt, waarin de α-synucleïne bevattende Lewy-inclusielichaampjes te zien zijn als oranje bolletjes. Deze oligodendrocyten vormen een isolerende myelinelaag (gele omhulsels) rondom neuronen (paarse cellen). Bij MSA-patiënten wordt deze myelinelaag niet correct gevormd. De groene bolletjes stellen de trofische stoffen voor, die minder geproduceerd worden bij MSA-patiënten. Hierdoor zullen de neuronen afsterven, en dus de hersenen verschrompelen.
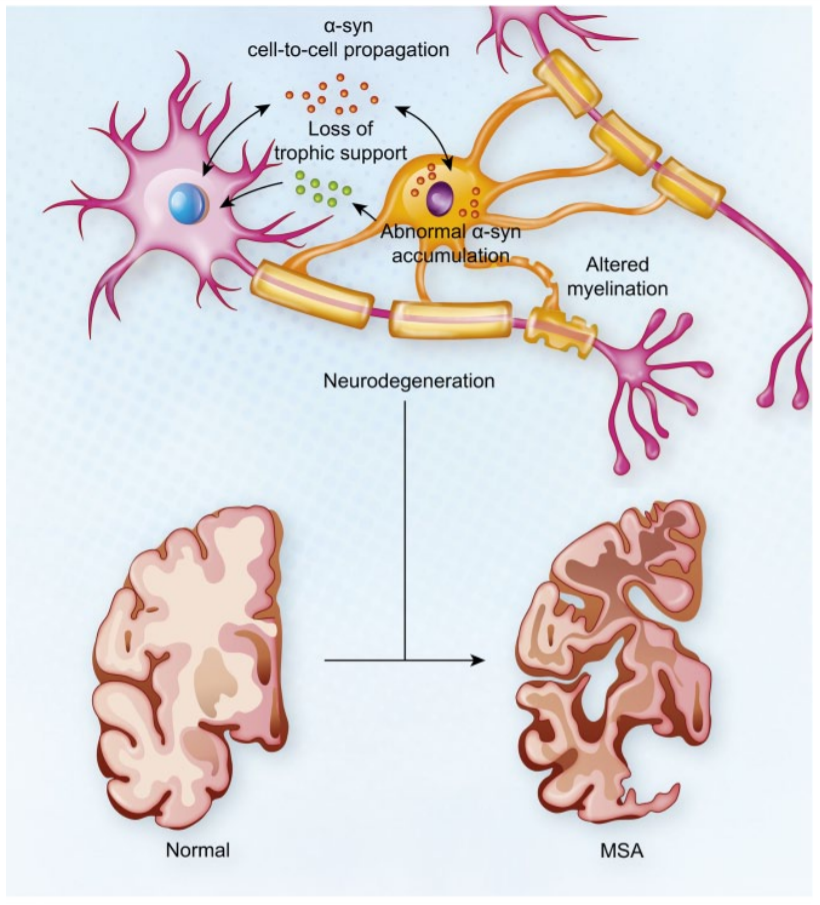
Figuur 1. De onderliggende ziektemechanismen bij MSA. (uit CurryHyde A, Chen BJ, Ueberham U, Arendt T and Janitz M. Multiple System Atrophy: Many Lessons from the Transcriptome. NEUROSCIENTIST. 2017 Aug;24(3):294-307)
Nood aan therapeutische strategieën!
Hoe deze eiwitophopingen precies ontstaan en waarom dit gebeurt, blijft voorlopig nog een raadsel. Het is dus ook niet onbegrijpelijk dat er nog steeds geen efficiënte therapieën ontwikkeld zijn die de ontstaans- en werkingsmechanismen van MSA tegenwerken. In onze onderzoeksgroep hebben we geprobeerd om het mechanisme van deze eiwitophoping na te bootsen met behulp van virale vectortechnologie in knaagdieren. Zo trachten we een efficiënt ziektemodel te maken, die de parkinsonisme variant van MSA nabootst. Hierop kunnen nieuwe geneesmiddelen uitgetest worden, waardoor nieuwe therapeutische strategieën ontwikkeld kunnen worden.
Onze onderzoeksgroep is gespecialiseerd in deze virale vectortechnologie. We zijn er met deze technologie al in geslaagd om een succesvol ziektemodel van de ziekte van Parkinson te maken in knaagdieren. Daarom was dit project een logische vervolgstap op het vorige succes.
Virale vectortechnologie, hoe werkt dat?
Een virale vector is een stukje DNA, verpakt in een viraal omhulsel, zoals in onderstaande afbeelding uitgebeeld wordt. Dit stukje DNA hebben wij genetisch aangepast, waardoor het het α-synucleïne eiwit specifiek zou aanmaken in oligodendrocyten. Na de toediening van deze virale vectoren in de hersenen van de knaagdieren zal het eiwit aangemaakt worden. Deze eiwitten zullen ophopen in Lewy-inclusielichaampjes, waardoor de normale werking van deze oligodendrocyten, en dus de ondersteuning van naburige neuronen in gedrang zal komen.
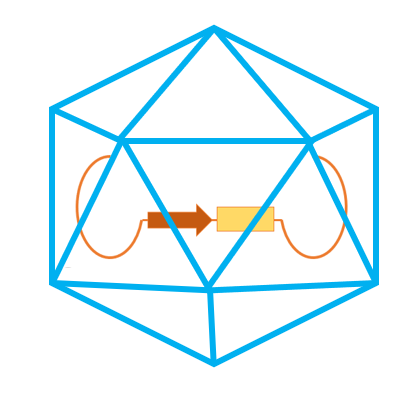
Figuur 2. Een virale vector. Deze bevat een stukje genetisch aangepast DNA (oranje) en is verpakt in een viraal omhulsel (blauw).
Wat zijn de resultaten? Zijn we erin geslaagd?
We hebben kunnen aantonen dat deze virale vectoren erin geslaagd zijn om de productie van het α-synucleïne proteïne in de ondersteunende oligodendrocyten op gang te brengen. Daardoor ontstonden eiwitophopingen die overeenkomen met Lewy-inclusielichaampjes. Daarnaast hebben we ook ontdekt dat de isolerende myelinelaag rondom de neuronen zichtbaar afgenomen was in de hersenen van de behandelde knaagdieren. Helaas was dit nog steeds onvoldoende om de typische motorische beperkingen van MSA-P uit te lokken in deze knaagdieren. Dit sluit natuurlijk niet uit dat het in de toekomst, onder andere omstandigheden, wél mogelijk zal zijn om een ziektemodel te maken voor MSA-P. Daarnaast blijft het mysterie van het ontstaan van de Lewy-inclusielichaampjes tot op de dag van vandaag nog onopgelost, dus er is nog steeds veel werk aan de winkel!
Bibliografie
Bronnen:
- Baumann N, PhamDinh D. Biology of Oligodendrocyte and Myelin in the Mammalian Central Nervous System. Physiol Rev. 2001 Apr;81(2):871–927.
- CurryHyde A, Chen BJ, Ueberham U, Arendt T and Janitz M. Multiple System Atrophy: Many Lessons from the Transcriptome. NEUROSCIENTIST. 2017 Aug;24(3):294-307.
- Dickson DW. Parkinson’s disease and parkinsonism: neuropathology. Cold Spring Harb Perspect Med. 2012 Aug;2(8):a009258.
- Fernagut PO, Ghorayeb I, Diguet E, Tison F. In vivo models of multiple system atrophy. Mov Disord. 2005 Aug;20(S12):S57–63.
- Gilman S, Low P, Quinn N, Albanese A, BenShlomo Y, Fowler C, et al. Consensus statement on the diagnosis of multiple system atrophy. American Autonomic Society and American Academy of Neurology. Clin Auton Res. 1998 Dec;8(6):359–62.
- Gilman S. Parkinsonian Syndromes. Clin Geriatr Med. 2006 Nov;22(4):827–42.
- Grazia Spillantini M, Anthony Crowther R, Jakes R, Cairns NJ, Lantos PL, Goedert M. Filamentous αsynuclein inclusions link multiple system atrophy with Parkinson’s disease and dementia with Lewy bodies. Neurosci Lett. 1998 Jul;251(3):205–8.
- Papp MI, Kahn JE, Lantos PL. Glial cytoplasmic inclusions in the CNS of patients with multiple system atrophy (striatonigral degeneration, olivopontocerebellar atrophy and ShyDrager syndrome). J Neurol Sci. 1989 Dec;94(1–3):79–100.
- Polymeropoulos MH, Lavedan C, Leroy E, Ide SE, Dehejia A, Dutra A, et al. Mutation in the alphasynuclein gene identified in families with Parkinson’s disease. Science. 1997 Jun;276(5321):2045–7.
- Quinn N. Multiple system atrophy-the nature of the beast. J Neurol Neurosurg Psychiatry. 1989 Jun;Suppl(Suppl):78–89.
- Rob. Rob aan het woord van 2005 tot 2013… Beschikbaar via: http://www.msaams.be/MSA-AMS/VERHALEN_VAN/Artikelen/2013/8/1_Rob_aan_het_woord_van_2005_tot_2013....html . Geraadpleegd op 30 September 2019.
- Samulski RJ, Muzyczka N. AAVMediated Gene Therapy for Research and Therapeutic Purposes. Annu Rev Virol. 2014 Nov;1(1):427–51
- Schrag A, BenShlomo Y, Quinn N. Prevalence of progressive supranuclear palsy and multiple system atrophy: a cross-sectional study. Lancet. 1999 Nov;354(9192):1771–5.
- Tison F, Yekhlef F, Chrysostome V, Sourgen C. Prevalence of multiple system atrophy. Lancet (London, England). 2000 Feb;355(9202):495–6.
- Trojanowski JQ, Lee VMY. Parkinson’s Disease and Related αSynucleinopathies Are Brain Amyloidoses. Ann N Y Acad Sci. 2006 Jan;991(1):107–10.
- Uversky VN, Li J, Fink AL. Evidence for a partially folded intermediate in alphasynuclein fibril formation. J Biol Chem. 2001 Apr;276(14):10737–44.
- Wakabayashi K, Yoshimoto M, Tsuji S, Takahashi H. Alphasynuclein immunoreactivity in glial cytoplasmic inclusions in multiple system atrophy. Neurosci Lett. 1998 Jun;249(2–3):180–2.
- Watanabe H, Saito Y, Terao S, Ando T, Kachi T, Mukai E, et al. Progression and prognosis in multiple system atrophy. Brain. 2002 May;125(5):1070–83.
- Wenning GK, Ben Shlomo Y, Magalhães M, Daniel SE, Quinn NP. Clinical features and natural history of multiple system atrophy. An analysis of 100 cases. Brain. 1994 Aug;117 ( Pt 4):835–45.
- Wirdefeldt K, Adami HO, Cole P, Trichopoulos D, Mandel J. Epidemiology and etiology of Parkinson’s disease: a review of the evidence. Eur J Epidemiol. 2011 Jun;26(S1):1–58.









