Kwaadaardige plasmacellen secreten kleine vesikels met gewijzigde inhoud die bijdragen tot het herval van multipel myeloom patiënten.
Kanker. De meest voorkomende doodsoorzaak in België, na hart- en vaatziekten. Jaarlijks worden ongeveer 70 000 Belgen met kanker gediagnosticeerd, terwijl zo’n 35 000 patiënten elk jaar de strijd verliezen. De meest voorkomende kankers bij Belgen zijn long-, borst-, maag- en darmkanker. Overlevingscijfers verschillen per type kanker, maar ook de leeftijd, algemene conditie en stadium (I-IV) beïnvloeden de overlevingskansen sterk. Kankerpatiënten kunnen na een intensieve behandeling genezen verklaard worden. Echter, deze eerste kanker kan na een periode van complete remissie toch opnieuw opduiken, wat deskundigen een herval noemen (1,2).
Multipel myeloom
Multipel myeloom, ook wel ziekte van Kahler genoemd, is een bloedkanker met een abnormaal hoog aantal witte bloedcellen, nl. de plasmacellen. In normale omstandigheden vechten deze plasmacellen tegen infecties door productie van verschillende antilichamen. In geval van multipel myeloom worden er echter te veel dezelfde plasmacellen geproduceerd die ook nog eens dezelfde antilichamen aanmaken. De patiënt kan zich niet goed meer verweren tegen infecties, maar ook de normale rode bloedcel-productie en botaanmaak zijn aangetast. Deze patiënten komen vaak in het ziekenhuis terecht met botbreuken, alsook oververmoeidheid en uitputting. Hoewel er momenteel goedwerkende geneesmiddelen bestaan om deze ziekte te overwinnen, zal het merendeel hervallen. Eens dit gebeurt, bestaan er nog maar weinig mogelijkheden om de patiënt te helpen. De grootste oorzaak van herval is het optreden van resistentie, waarbij de kankercellen niet langer gevoelig zijn aan de toegediende geneesmiddelen. De kankercellen herpakken zich namelijk en brengen zowel veranderingen aan zichzelf als de omgeving aan zodat zij niet langer gedood worden door de gebruikte geneesmiddelen. Hierdoor is er een noodzaak aan nieuwe geneesmiddelen om de resistentie te overwinnen. Slechts 50% van de myeloompatiënten zal 5 jaar na initiële diagnose nog in leven zijn (3).
Lipiden als nieuw aangrijpingspunt in de behandeling tegen multipel myeloom
Om nieuwe therapieën te ontdekken, voerden we een assay uit op bloedstalen waarbij de concentraties van verschillende lipiden van gezonde vrijwilligers werden vergeleken met myeloompatiënten. Lipiden zijn vetten of vetachtige stoffen die niet oplosbaar zijn in water, maar wel in alcohol. Ze spelen een belangrijke rol in membraanfysiologie van cellen en metabolisme. Bekende voorbeelden zijn cholesterol en triglyceriden (= eetbare vetten en oliën). Het bloed van myeloompatiënten bevat hoge hoeveelheden ceramide en lage hoeveelheden sfingomyeline (allebei een type lipide). Dit kan verklaard worden door een verhoogde aanwezigheid van het enzym sfingomyelinase (SMase), dat sfingomyeline omzet naar ceramide (fig 1).
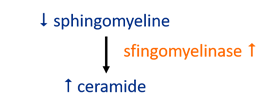
Figuur 1: Myeloompatiënten bezitten een ander lipidenprofiel dan gezonde vrijwilligers. Het bloed van myeloompatiënten bevat minder sfingomyeline en meer ceramide, wat verklaard kan worden door een verhoogde aanwezigheid van het enzym sfingomyelinase.
Kleine vesikels brengen boodschappen over tussen kankercellen en de omgeving
Kleine vesikels zijn blaasjes die omgeven zijn door een lipide-rijk membraan en allerlei stoffen bevatten. Ze worden door cellen aangemaakt, gesecreteerd en opgenomen door naburige cellen. Hierdoor functioneren zij o.a. als boodschappermoleculen tussen de verschillende celtypes. Aangezien verschillende onderzoeksgroepen, waaronder ook onze groep, al hebben aangetoond dat de secretie en opname van kleine vesikels bijdragen tot resistentie in kanker, hebben we ook onderzocht of zuur SMase (zSMase) aanwezig is in deze vesikels. We behandelden myeloomcellen met melfalan en bortezomib, twee vaak gebruikte geneesmiddelen in myeloom. Hieruit isoleerden we kleine vesikels met een neerslagreactie. Enzym analyse toonde een verhoogde zSMase inhoud aan wanneer deze behandeld werden met melfalan en bortezomib (fig 2a). Aangezien we wilden bevestigen dat zSMase bijdraagt tot resistentie en dus verhoogde leefbaarheid van de myeloomcellen, behandelden we deze cellen met twee soorten vesikels, nl. vesikels met lage zSMase inhoud en vesikels met hoge zSMase inhoud. Inderdaad, na een 24 uur-durende behandeling verhoogden de vesikels met hoge zSMase inhoud de leefbaarheid van de myeloomcellen. Vesikels met een lage zSMase inhoud deden dit niet (fig 2b).
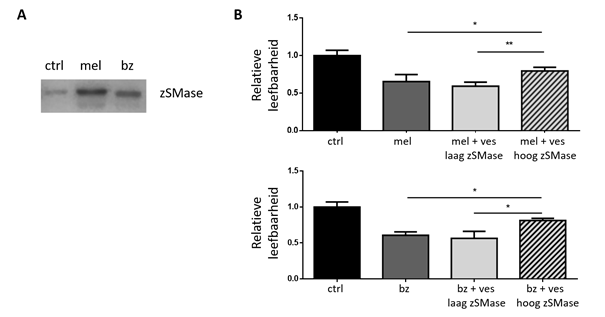
Figuur 2: Myeloomcel-gesecrete vesikels bevatten zSMase. A. Melfalan en bortezomib verhogen de zSMase inhoud in vesikels. B. Vesikels met hoge zSMase inhoud vergroten de leefbaarheid van de myeloomcellen vergeleken met vesikels die weinig tot geen zSMase inhoud bevatten. Ctrl = controle, mel = melfalan, bz = bortezomib, ves = vesikel, zSMase = zuur sfingomyelinase. * = p < 0.05, ** p = < 0.01.
Enzym blokkade versterkt werking klassieke geneesmiddelen
Sinds zSMase inhoud bijdraagt tot een verhoogde leefbaarheid van de myeloomcellen, onderzochten we ook of dit enzym geïnhibeerd kan worden, met als einddoel een sterfte van de myeloomcellen. Amitriptyline is een antidepressivum dat ook zSMase inhibeert. Combinatietherapie van amitriptyline met melfalan veroorzaakt zo’n 20% meer celdood na 24 uur behandeling vergeleken met melphalan als monotherapie. Combinatietherapie met bortezomib verlaagt het aantal levende cellen met 15% (fig 3).
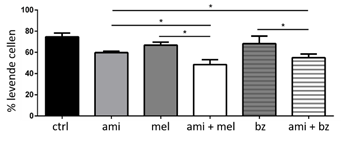
Figuur 3: Inhibitie van zSMase door amitriptyline veroorzaakt sterfte van de kankercellen. Myeloomcellen werden behandeld met amitriptyline, melfalan en bortezomib gedurende 24 uur. Combinatietherapie verlaagt het aantal levende myeloomcellen. Ctrl = controle, ami = amitriptyline, mel = melfalan, bz = bortezomib. * = p < 0.05.
Een nieuwe therapie voor multipel myeloom
Multipel myeloom is gekend voor zijn ontwikkeling van resistentie tegen geneesmiddelen, wat leidt tot de noodzaak van meerdere behandelingen in tijden van herval of verergering van de ziekte. Zelfs dan zullen de meeste patiënten uiteindelijk bezwijken aan deze kanker. Deze studie is de eerste die veranderingen in sfingolipiden in het bloed van myeloompatiënten identificeerde, waarbij we het geobserveerde verschil kunnen verklaren met een verhoogde aanwezigheid van zSMase in de myeloomcellen. De zSMase inhoud werd gecorreleerd met resistentie, waarbij de klassieke geneesmiddelen de zSMase hoeveelheid verhoogden, en myeloomcellen hun resistente eigenschappen konden overdragen naar andere naburige myeloomcellen door transfer van zSMase-rijke vesikels. Inhibitie van dit enzym met amitriptyline, een goedkoop en vaak gebruikt antidepressivum, verhoogde de werkzaamheid van de gebruikte klassieke geneesmiddelen. Deze studie biedt een rationale aan om zSMase-gerichte geneesmiddelen toe te voegen aan de huidige combinatietherapieën in myeloom patiënten.
(1) “Stichting tegen Kanker,” https://www.kanker.be/, 2019, accessed: October 1, 2019.
(2) “Belgian Cancer Registry,” https://kankerregister.org/, 2019, accessed: October 1, 2019.
(3) “Cancer net,” https://www.cancer.net/, 2019, accessed: October 1, 2019.
Bibliografie
1. R. L. Siegel, K. D. Miller, A. Jemal, Cancer statistics, 2018. CA Cancer J Clin 68, 7-30 (2018).
2. M. S. Raab, K. Podar, I. Breitkreutz, P. G. Richardson, K. C. Anderson, Multiple myeloma. Lancet 374, 324-339 (2009).
3. J. Caers et al., Multiple myeloma--an update on diagnosis and treatment. Eur J Haematol 81, 329-343 (2008).
4. A. S. Schey, J. Morris, A. Maguire, S. Dhanasiri, Quantifying the Burden of Multiple Myeloma Across Europe. Blood 128, (2016).
5. S. K. Kumar et al., Multiple myeloma. Nat Rev Dis Primers 3, 17046 (2017).
6. R. A. Kyle et al., Review of 1027 patients with newly diagnosed multiple myeloma. Mayo Clin Proc 78, 21-33 (2003).
7. A. J. Waxman et al., Racial disparities in incidence and outcome in multiple myeloma: a population-based study. Blood 116, 5501-5506 (2010).
8. S. Y. Huang et al., Epidemiology of multiple myeloma in Taiwan: increasing incidence for the past 25 years and higher prevalence of extramedullary myeloma in patients younger than 55 years. Cancer 110, 896-905 (2007).
9. O. Landgren, B. M. Weiss, Patterns of monoclonal gammopathy of undetermined significance and multiple myeloma in various ethnic/racial groups: support for genetic factors in pathogenesis. Leukemia 23, 1691-1697 (2009).
10. S. V. Rajkumar et al., International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 15, e538-548 (2014).
11. S. V. Rajkumar, MGUS and smoldering multiple myeloma: update on pathogenesis, natural history, and management. Hematology Am Soc Hematol Educ Program, 340-345 (2005).
12. T. W. LeBien, T. F. Tedder, B lymphocytes: how they develop and function. Blood 112, 1570-1580 (2008).
13. M. Shapiro-Shelef, K. Calame, Plasma cell differentiation and multiple myeloma. Curr Opin Immunol 16, 226-234 (2004).
14. S. K. Kumar, S. V. Rajkumar, The multiple myelomas - current concepts in cytogenetic classification and therapy. Nat Rev Clin Oncol 15, 409-421 (2018).
15. R. Fonseca et al., International Myeloma Working Group molecular classification of multiple myeloma: spotlight review. Leukemia 23, 2210-2221 (2009).
16. S. Kumar et al., Trisomies in multiple myeloma: impact on survival in patients with high-risk cytogenetics. Blood 119, 2100-2105 (2012).
17. R. Fonseca et al., Genomic abnormalities in monoclonal gammopathy of undetermined significance. Blood 100, 1417-1424 (2002).
18. R. Fonseca et al., Genetics and cytogenetics of multiple myeloma: a workshop report. Cancer Res 64, 1546-1558 (2004).
19. R. Fonseca et al., The recurrent IgH translocations are highly associated with nonhyperdiploid variant multiple myeloma. Blood 102, 2562-2567 (2003).
20. R. Fonseca et al., Clinical and biologic implications of recurrent genomic aberrations in myeloma. Blood 101, 4569-4575 (2003).
21. A. Papadas, F. Asimakopoulos, Mechanisms of Resistance in Multiple Myeloma. Handb Exp Pharmacol, (2017).
22. H. Avet-Loiseau et al., Oncogenesis of multiple myeloma: 14q32 and 13q chromosomal abnormalities are not randomly distributed, but correlate with natural history, immunological features, and clinical presentation. Blood 99, 2185-2191 (2002).
23. B. G. Durie, S. E. Salmon, A clinical staging system for multiple myeloma. Correlation of measured myeloma cell mass with presenting clinical features, response to treatment, and survival. Cancer 36, 842-854 (1975).
24. L. Bieghs et al., The insulin-like growth factor system in multiple myeloma: diagnostic and therapeutic potential. Oncotarget 7, 48732-48752 (2016).
25. C. M. Edwards, J. Zhuang, G. R. Mundy, The pathogenesis of the bone disease of multiple myeloma. Bone 42, 1007-1013 (2008).
26. M. Mittelman, The implications of anemia in multiple myeloma. Clin Lymphoma 4 Suppl 1, S23-29 (2003).
27. M. A. Dimopoulos, E. Kastritis, L. Rosinol, J. Bladé, H. Ludwig, Pathogenesis and treatment of renal failure in multiple myeloma. Leukemia 22, 1485-1493 (2008).
28. P. R. Greipp et al., International staging system for multiple myeloma. J Clin Oncol 23, 3412-3420 (2005).
29. A. Palumbo et al., Revised International Staging System for Multiple Myeloma: A Report From International Myeloma Working Group. J Clin Oncol 33, 2863-2869 (2015).
30. J. R. Berenson et al., Maintenance therapy with alternate-day prednisone improves survival in multiple myeloma patients. Blood 99, 3163-3168 (2002).
31. R. Alexanian, M. A. Dimopoulos, K. Delasalle, B. Barlogie, Primary dexamethasone treatment of multiple myeloma. Blood 80, 887-890 (1992).
32. B. Faiman, E. Bilotti, P. A. Mangan, K. Rogers, I. N. L. Board, Steroid-associated side effects in patients with multiple myeloma: consensus statement of the IMF Nurse Leadership Board. Clin J Oncol Nurs 12, 53-63 (2008).
33. P. Moreau et al., Proteasome inhibitors in multiple myeloma: 10 years later. Blood 120, 947-959 (2012).
34. A. Ciechanover, The ubiquitin-proteasome pathway: on protein death and cell life. EMBO J 17, 7151-7160 (1998).
35. S. Andhavarapu, V. Roy, Immunomodulatory drugs in multiple myeloma. Expert Rev Hematol 6, 69-82 (2013).
36. G. Li et al., Highly compacted chromatin formed in vitro reflects the dynamics of transcription activation in vivo. Mol Cell 38, 41-53 (2010).
37. F. Perri et al., Epigenetic control of gene expression: Potential implications for cancer treatment. Crit Rev Oncol Hematol 111, 166-172 (2017).
38. N. E. Papaioannou, O. V. Beniata, P. Vitsos, O. Tsitsilonis, P. Samara, Harnessing the immune system to improve cancer therapy. Ann Transl Med 4, 261 (2016).
39. L. E. Franssen, T. Mutis, H. M. Lokhorst, N. W. C. J. van de Donk, Immunotherapy in myeloma: how far have we come? Ther Adv Hematol 10, 2040620718822660 (2019).
40. D. W. Sherbenou, T. M. Mark, P. Forsberg, Monoclonal Antibodies in Multiple Myeloma: A New Wave of the Future. Clin Lymphoma Myeloma Leuk 17, 545-554 (2017).
41. P. Moreau et al., Multiple myeloma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 28, iv52-iv61 (2017).
42. S. Manier, A. Sacco, X. Leleu, I. M. Ghobrial, A. M. Roccaro, Bone marrow microenvironment in multiple myeloma progression. J Biomed Biotechnol 2012, 157496 (2012).
43. S. Kumar et al., Expression of VEGF and its receptors by myeloma cells. Leukemia 17, 2025-2031 (2003).
44. F. Radtke, K. Raj, The role of Notch in tumorigenesis: oncogene or tumour suppressor? Nat Rev Cancer 3, 756-767 (2003).
45. Y. Nefedova, P. Cheng, M. Alsina, W. S. Dalton, D. I. Gabrilovich, Involvement of Notch-1 signaling in bone marrow stroma-mediated de novo drug resistance of myeloma and other malignant lymphoid cell lines. Blood 103, 3503-3510 (2004).
46. A. C. Sprynski et al., The role of IGF-1 as a major growth factor for myeloma cell lines and the prognostic relevance of the expression of its receptor. Blood 113, 4614-4626 (2009).
47. T. Hideshima, P. L. Bergsagel, W. M. Kuehl, K. C. Anderson, Advances in biology of multiple myeloma: clinical applications. Blood 104, 607-618 (2004).
48. Z. W. Li, H. Chen, R. A. Campbell, B. Bonavida, J. R. Berenson, NF-kappaB in the pathogenesis and treatment of multiple myeloma. Curr Opin Hematol 15, 391-399 (2008).
49. M. P. Duyao, A. J. Buckler, G. E. Sonenshein, Interaction of an NF-kappa B-like factor with a site upstream of the c-myc promoter. Proc Natl Acad Sci U S A 87, 4727-4731 (1990).
50. M. Hecht, I. von Metzler, K. Sack, M. Kaiser, O. Sezer, Interactions of myeloma cells with osteoclasts promote tumour expansion and bone degradation through activation of a complex signalling network and upregulation of cathepsin K, matrix metalloproteinases (MMPs) and urokinase plasminogen activator (uPA). Exp Cell Res 314, 1082-1093 (2008).
51. M. Lemaire et al., The microenvironment and molecular biology of the multiple myeloma tumor. Adv Cancer Res 110, 19-42 (2011).
52. T. Hideshima, K. C. Anderson, Molecular mechanisms of novel therapeutic approaches for multiple myeloma. Nat Rev Cancer 2, 927-937 (2002).
53. K. Podar, K. C. Anderson, The pathophysiologic role of VEGF in hematologic malignancies: therapeutic implications. Blood 105, 1383-1395 (2005).
54. A. Vacca et al., A paracrine loop in the vascular endothelial growth factor pathway triggers tumor angiogenesis and growth in multiple myeloma. Haematologica 88, 176-185 (2003).
55. A. Vacca et al., Bone marrow neovascularization, plasma cell angiogenic potential, and matrix metalloproteinase-2 secretion parallel progression of human multiple myeloma. Blood 93, 3064-3073 (1999).
56. E. Terpos et al., Soluble receptor activator of nuclear factor kappaB ligand-osteoprotegerin ratio predicts survival in multiple myeloma: proposal for a novel prognostic index. Blood 102, 1064-1069 (2003).
57. R. N. Pearse et al., Multiple myeloma disrupts the TRANCE/ osteoprotegerin cytokine axis to trigger bone destruction and promote tumor progression. Proc Natl Acad Sci U S A 98, 11581-11586 (2001).
58. E. Tian et al., The role of the Wnt-signaling antagonist DKK1 in the development of osteolytic lesions in multiple myeloma. N Engl J Med 349, 2483-2494 (2003).
59. Y. W. Qiang et al., Myeloma-derived Dickkopf-1 disrupts Wnt-regulated osteoprotegerin and RANKL production by osteoblasts: a potential mechanism underlying osteolytic bone lesions in multiple myeloma. Blood 112, 196-207 (2008).
60. E. Terpos, M. Politou, N. Viniou, A. Rahemtulla, Significance of macrophage inflammatory protein-1 alpha (MIP-1alpha) in multiple myeloma. Leuk Lymphoma 46, 1699-1707 (2005).
61. J. Abdi, G. Chen, H. Chang, Drug resistance in multiple myeloma: latest findings and new concepts on molecular mechanisms. Oncotarget 4, 2186-2207 (2013).
62. L. Di Marzo et al., Microenvironment drug resistance in multiple myeloma: emerging new players. Oncotarget 7, 60698-60711 (2016).
63. M. M. Gottesman, Mechanisms of cancer drug resistance. Annu Rev Med 53, 615-627 (2002).
64. Y. Nefedova, T. H. Landowski, W. S. Dalton, Bone marrow stromal-derived soluble factors and direct cell contact contribute to de novo drug resistance of myeloma cells by distinct mechanisms. Leukemia 17, 1175-1182 (2003).
65. J. Abraham, N. N. Salama, A. K. Azab, The role of P-glycoprotein in drug resistance in multiple myeloma. Leuk Lymphoma 56, 26-33 (2015).
66. D. J. Kuhn et al., Targeting the insulin-like growth factor-1 receptor to overcome bortezomib resistance in preclinical models of multiple myeloma. Blood 120, 3260-3270 (2012).
67. D. Xu et al., Dll1/Notch activation contributes to bortezomib resistance by upregulating CYP1A1 in multiple myeloma. Biochem Biophys Res Commun 428, 518-524 (2012).
68. K. Dimopoulos, P. Gimsing, K. Grønbæk, The role of epigenetics in the biology of multiple myeloma. Blood Cancer J 4, e207 (2014).
69. M. E. Figueroa et al., DNA methylation signatures identify biologically distinct subtypes in acute myeloid leukemia. Cancer Cell 17, 13-27 (2010).
70. P. Muñoz, M. S. Iliou, M. Esteller, Epigenetic alterations involved in cancer stem cell reprogramming. Mol Oncol 6, 620-636 (2012).
71. M. E. Issa et al., Epigenetic strategies to reverse drug resistance in heterogeneous multiple myeloma. Clin Epigenetics 9, 17 (2017).
72. P. A. Jones, S. B. Baylin, The fundamental role of epigenetic events in cancer. Nat Rev Genet 3, 415-428 (2002).
73. R. Richelda et al., A novel chromosomal translocation t(4; 14)(p16.3; q32) in multiple myeloma involves the fibroblast growth-factor receptor 3 gene. Blood 90, 4062-4070 (1997).
74. Y. Kawano et al., Targeting the bone marrow microenvironment in multiple myeloma. Immunol Rev 263, 160-172 (2015).
75. I. Hwang, Cell-cell communication via extracellular membrane vesicles and its role in the immune response. Mol Cells 36, 105-111 (2013).
76. G. Raposo, W. Stoorvogel, Extracellular vesicles: exosomes, microvesicles, and friends. J Cell Biol 200, 373-383 (2013).
77. J. Wang et al., Extracellular vesicle cross-talk in the bone marrow microenvironment: implications in multiple myeloma. Oncotarget 7, 38927-38945 (2016).
78. J. R. Edgar, Q&A: What are exosomes, exactly? BMC Biol 14, 46 (2016).
79. A. Zomer et al., Exosomes: Fit to deliver small RNA. Commun Integr Biol 3, 447-450 (2010).
80. W. C. Newton, J. W. Kim, J. Z. Q. Luo, L. Luo, Stem cell-derived exosomes: a novel vector for tissue repair and diabetic therapy. J Mol Endocrinol 59, R155-R165 (2017).
81. Y. L. Tai, K. C. Chen, J. T. Hsieh, T. L. Shen, Exosomes in cancer development and clinical applications. Cancer Sci 109, 2364-2374 (2018).
82. A. Elsherbini, E. Bieberich, Ceramide and Exosomes: A Novel Target in Cancer Biology and Therapy. Adv Cancer Res 140, 121-154 (2018).
83. J. Wang et al., Multiple myeloma exosomes establish a favourable bone marrow microenvironment with enhanced angiogenesis and immunosuppression. J Pathol 239, 162-173 (2016).
84. B. Chen et al., Myeloma Exosomes Prime the Microenvironment to Support Survival and Growth of Myeloma Cells. Blood, (2016).
85. Y. Liu et al., Microvesicles secreted from human multiple myeloma cells promote angiogenesis. Acta Pharmacol Sin 35, 230-238 (2014).
86. T. Umezu et al., Exosomal miR-135b shed from hypoxic multiple myeloma cells enhances angiogenesis by targeting factor-inhibiting HIF-1. Blood 124, 3748-3757 (2014).
87. J. Wang et al., Bone marrow stromal cell-derived exosomes as communicators in drug resistance in multiple myeloma cells. Blood 124, 555-566 (2014).
88. F. Yan, H. Zhao, Y. Zeng, Lipidomics: a promising cancer biomarker. Clin Transl Med 7, 21 (2018).
89. T. W. Grunt, Interacting Cancer Machineries: Cell Signaling, Lipid Metabolism, and Epigenetics. Trends Endocrinol Metab 29, 86-98 (2018).
90. S. Beloribi-Djefaflia, S. Vasseur, F. Guillaumond, Lipid metabolic reprogramming in cancer cells. Oncogenesis 5, e189 (2016).
91. B. Peck, A. Schulze, Lipid desaturation - the next step in targeting lipogenesis in cancer? FEBS J 283, 2767-2778 (2016).
92. K. Ekroos, M. Jänis, K. Tarasov, R. Hurme, R. Laaksonen, Lipidomics: a tool for studies of atherosclerosis. Curr Atheroscler Rep 12, 273-281 (2010).
93. S. Rauschert et al., Lipidomics Reveals Associations of Phospholipids With Obesity and Insulin Resistance in Young Adults. J Clin Endocrinol Metab 101, 871-879 (2016).
94. F. Baenke, B. Peck, H. Miess, A. Schulze, Hooked on fat: the role of lipid synthesis in cancer metabolism and tumour development. Dis Model Mech 6, 1353-1363 (2013).
95. M. Heusinkveld et al., M2 macrophages induced by prostaglandin E2 and IL-6 from cervical carcinoma are switched to activated M1 macrophages by CD4+ Th1 cells. J Immunol 187, 1157-1165 (2011).
96. J. Ecker et al., Induction of fatty acid synthesis is a key requirement for phagocytic differentiation of human monocytes. Proc Natl Acad Sci U S A 107, 7817-7822 (2010).
97. S. S. Im et al., Linking lipid metabolism to the innate immune response in macrophages through sterol regulatory element binding protein-1a. Cell Metab 13, 540-549 (2011).
98. J. Rolin, A. A. Maghazachi, Effects of lysophospholipids on tumor microenvironment. Cancer Microenviron 4, 393-403 (2011).
99. R. Sutphen et al., Lysophospholipids are potential biomarkers of ovarian cancer. Cancer Epidemiol Biomarkers Prev 13, 1185-1191 (2004).
100. H. Babahosseini, P. C. Roberts, E. M. Schmelz, M. Agah, Roles of bioactive sphingolipid metabolites in ovarian cancer cell biomechanics. Conf Proc IEEE Eng Med Biol Soc 2012, 2436-2439 (2012).
101. G. F. Giskeødegård et al., Metabolic markers in blood can separate prostate cancer from benign prostatic hyperplasia. Br J Cancer 113, 1712-1719 (2015).
102. S. Bandyopadhyay et al., Mechanism of apoptosis induced by the inhibition of fatty acid synthase in breast cancer cells. Cancer Res 66, 5934-5940 (2006).
103. P. Visca et al., Fatty acid synthase (FAS) is a marker of increased risk of recurrence in lung carcinoma. Anticancer Res 24, 4169-4173 (2004).
104. T. Kusakabe, A. Nashimoto, K. Honma, T. Suzuki, Fatty acid synthase is highly expressed in carcinoma, adenoma and in regenerative epithelium and intestinal metaplasia of the stomach. Histopathology 40, 71-79 (2002).
105. H. Y. Kwan et al., Dietary lipids and adipocytes: potential therapeutic targets in cancers. J Nutr Biochem 26, 303-311 (2015).
106. B. Ogretmen, Y. A. Hannun, Biologically active sphingolipids in cancer pathogenesis and treatment. Nat Rev Cancer 4, 604-616 (2004).
107. S. Ponnusamy et al., Sphingolipids and cancer: ceramide and sphingosine-1-phosphate in the regulation of cell death and drug resistance. Future Oncol 6, 1603-1624 (2010).
108. S. A. Saddoughi, B. Ogretmen, Diverse functions of ceramide in cancer cell death and proliferation. Adv Cancer Res 117, 37-58 (2013).
109. A. Draeger, E. B. Babiychuk, Ceramide in plasma membrane repair. Handb Exp Pharmacol, 341-353 (2013).
110. Y. Pewzner-Jung et al., A critical role for ceramide synthase 2 in liver homeostasis: I. alterations in lipid metabolic pathways. J Biol Chem 285, 10902-10910 (2010).
111. Z. Cai et al., Alteration of the sphingomyelin/ceramide pathway is associated with resistance of human breast carcinoma MCF7 cells to tumor necrosis factor-alpha-mediated cytotoxicity. J Biol Chem 272, 6918-6926 (1997).
112. C. Hajj, K. A. Becker-Flegler, A. Haimovitz-Friedman, Novel mechanisms of action of classical chemotherapeutic agents on sphingolipid pathways. Biol Chem 396, 669-679 (2015).
113. P. K. Mistry, T. Taddei, S. vom Dahl, B. E. Rosenbloom, Gaucher disease and malignancy: a model for cancer pathogenesis in an inborn error of metabolism. Crit Rev Oncog 18, 235-246 (2013).
114. O. Landgren et al., Obesity is associated with an increased risk of monoclonal gammopathy of undetermined significance among black and white women. Blood 116, 1056-1059 (2010).
115. S. Upparahallivenkateshaiah et al., Upregulation of Lipid Metabolism Modulators in Myeloma Cells Underlines Their Progression in a Supportive Microenvironment and Linking Metabolic Pathways with Growth Signaling. Blood 120, 329 (2012).
116. S. Nair et al., Clonal Immunoglobulin against Lysolipids in the Origin of Myeloma. N Engl J Med 374, 555-561 (2016).
117. J. M. Tirado-Vélez, I. Joumady, A. Sáez-Benito, I. Cózar-Castellano, G. Perdomo, Inhibition of fatty acid metabolism reduces human myeloma cells proliferation. PLoS One 7, e46484 (2012).
118. A. Talebi et al., Sustained SREBP-1-dependent lipogenesis as a key mediator of resistance to BRAF-targeted therapy. Nat Commun 9, 2500 (2018).
119. M. Needle et al. (Blood Journal, 2012), vol. 120.
120. L. Herviou et al., PRC2 targeting is a therapeutic strategy for EZ score defined high-risk multiple myeloma patients and overcome resistance to IMiDs. Clin Epigenetics 10, 121 (2018).
121. D. Pieragostino et al., Enhanced release of acid sphingomyelinase-enriched exosomes generates a lipidomics signature in CSF of Multiple Sclerosis patients. Sci Rep 8, 3071 (2018).
122. S. Faict et al., Exosomes play a role in multiple myeloma bone disease and tumor development by targeting osteoclasts and osteoblasts. Blood Cancer J 8, 105 (2018).
123. M. I. Qadir, S. A. Malik, Plasma lipid profile in gynecologic cancers. Eur J Gynaecol Oncol 29, 158-161 (2008).
124. A. Sorvina et al., Lipid profiles of prostate cancer cells. Oncotarget 9, 35541-35552 (2018).
125. F. Perrotti et al., Advances in Lipidomics for Cancer Biomarkers Discovery. Int J Mol Sci 17, (2016).
126. J. J. Keats, T. Reiman, A. R. Belch, L. M. Pilarski, Ten years and counting: so what do we know about t(4;14)(p16;q32) multiple myeloma. Leuk Lymphoma 47, 2289-2300 (2006).
127. Q. Cheng et al., The ceramide pathway is involved in the survival, apoptosis and exosome functions of human multiple myeloma cells in vitro. Acta Pharmacol Sin 39, 561-568 (2018).
128. S. Karahatay et al., Clinical relevance of ceramide metabolism in the pathogenesis of human head and neck squamous cell carcinoma (HNSCC): attenuation of C(18)-ceramide in HNSCC tumors correlates with lymphovascular invasion and nodal metastasis. Cancer Lett 256, 101-111 (2007).
129. S. A. Saddoughi et al., Results of a phase II trial of gemcitabine plus doxorubicin in patients with recurrent head and neck cancers: serum C₁₈-ceramide as a novel biomarker for monitoring response. Clin Cancer Res 17, 6097-6105 (2011).
130. V. Gouazé et al., Glucosylceramide synthase blockade down-regulates P-glycoprotein and resensitizes multidrug-resistant breast cancer cells to anticancer drugs. Cancer Res 65, 3861-3867 (2005).
131. C. Perrotta et al., The emerging role of acid sphingomyelinase in autophagy. Apoptosis 20, 635-644 (2015).
132. N. P. Hessvik, A. Llorente, Current knowledge on exosome biogenesis and release. Cell Mol Life Sci 75, 193-208 (2018).
133. S. K. Bandari et al., Chemotherapy induces secretion of exosomes loaded with heparanase that degrades extracellular matrix and impacts tumor and host cell behavior. Matrix Biol 65, 104-118 (2018).
134. N. H. Petersen et al., Transformation-associated changes in sphingolipid metabolism sensitize cells to lysosomal cell death induced by inhibitors of acid sphingomyelinase. Cancer Cell 24, 379-393 (2013).
135. N. Beckmann, D. Sharma, E. Gulbins, K. A. Becker, B. Edelmann, Inhibition of acid sphingomyelinase by tricyclic antidepressants and analogons. Front Physiol 5, 331 (2014).
136. E. Gulbins et al., Acid sphingomyelinase-ceramide system mediates effects of antidepressant drugs. Nat Med 19, 934-938 (2013).
137. Z. Zhang et al., The antidepressant amitriptyline shows potent therapeutic activity against multiple myeloma. Anticancer Drugs 24, 792-798 (2013).
138. X. Mao et al., The tricyclic antidepressant amitriptyline inhibits D-cyclin transactivation and induces myeloma cell apoptosis by inhibiting histone deacetylases: in vitro and in silico evidence. Mol Pharmacol 79, 672-680 (2011).









