Pancreaskanker: beter voorkomen dan genezen?
Tot op vandaag blijft pancreaskanker een ongeneeslijke ziekte met weinig hoopgevende statistieken. De wetenschap heeft aangetoond dat een proces waarbij cellen in de pancreas van identiteit veranderen, dat zich voordoet bij o.a. chronische ontsteking, aan de oorsprong kan liggen van pancreaskanker. In deze studie werd onderzocht welke genen hierin een rol spelen, met het oog op het blokkeren van dit proces om zo de ontwikkeling van pancreaskanker te voorkomen.
“Tegen het jaar 2000 zullen de meest voorkomende ‘moordenaars’, zoals hartziektes, beroertes, longziektes en vele kankers weggevaagd zijn.”, schreef de Irish Times in het jaar 1987. Nu, bijna 35 jaar later, is niets minder waar. Jaarlijks overlijden ongeveer 10 miljoen mensen wereldwijd aan kanker, waarvan meer dan 400.000 aan pancreaskanker. In ons land is het de vierde dodelijkste kanker, bij onze noorderburen zelfs de dodelijkste. Het meest opvallende: pancreaskanker is de enige kankersoort waarvan het sterftecijfer de laatste jaren amper gedaald is en waarvan het aantal gevallen toeneemt.
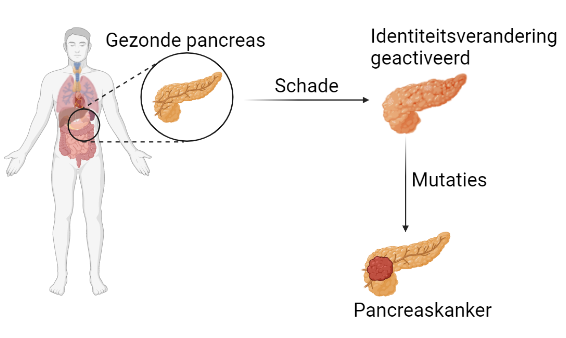
Doel van de studie
Wat pancreaskanker zo moeilijk maakt om te behandelen, is het feit dat de ziekte zich pas in een vergevorderde fase uit. Hierdoor kan een diagnose meestal pas laat gesteld worden en heeft de kanker zich al te sterk ontwikkeld om deze nog succesvol te kunnen behandelen.
Studies hebben aangetoond dat pancreascellen bij schade, zoals ontsteking, van identiteit veranderen als reactiemechanisme om aan de stress te ontsnappen. Dit zet echter de poort open voor een verdere ontwikkeling tot pancreaskanker. Daarom stelden we ons tot doel te ontdekken welke genen een belangrijke rol spelen in dit proces van identiteitscrisis. Wanneer we deze genen dan uitschakelen, speculeren we dat dit de ontwikkeling van pancreaskanker zou kunnen voorkomen.
De zoektocht naar interessante genen
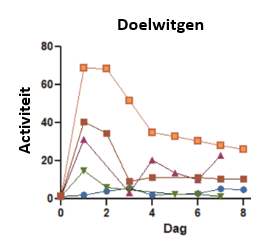
Om tot een lijst te komen met doelwitgenen die we verder zouden onderzoeken, werd eerst een analyse uitgevoerd. Hierbij werden de gezonde cellen van de pancreas vergeleken met cellen die reeds van identiteit veranderden. Vooral de genen die een hogere aanwezigheid toonden zouden dan wel eens een rol kunnen spelen in dit proces. Uit de lijst van doelwitgenen selecteerden wij er één voor verder onderzoek. Dit doelwitgen wordt geactiveerd wanneer cellen zich in een stressvolle situatie bevinden. In vele kankers wordt dit gen dan ook door de kankercellen geactiveerd zodat ze makkelijker kunnen overleven in de tumoromgeving, vandaar onze specifieke interesse.
Speelt ons doelwit een rol in de identiteitsverandering?
Gedurende acht dagen waarin de cellen van identiteit veranderen, werd elke dag de aanwezigheid van het doelwit gemeten. Op die manier kwamen we te weten dat het doelwit heel sterk stijgt wanneer de identiteit begint te veranderen en daarna terug naar normale niveaus daalt. Het doelwit zou dus vooral de identiteitsverandering in gang zetten, wat het zeer aantrekkelijk maakt om te proberen blokkeren.
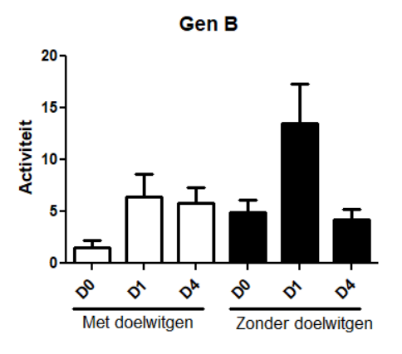
Is de identiteitsverandering gehinderd wanneer het doelwit wordt uitgeschakeld in muizen?
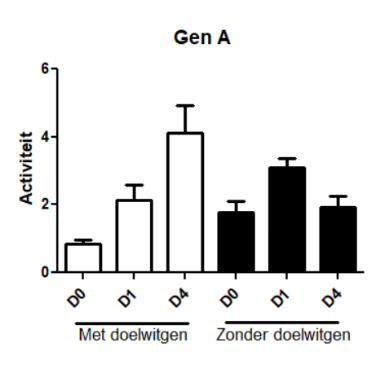
We gebruikten speciale muizen die het doelwit niet bezitten. Op die manier konden we vaststellen of de cellen nog steeds van identiteit veranderen bij stress, hetzelfde bleven of eventueel zouden bezwijken onder de stress. Aangezien het doelwit vooral in het begin nodig zou zijn, keken we voor deze analyse alleen naar dag nul (D0), dag één (D1) en dag vier (D4). Op het eerste gezicht leek het proces in afwezigheid van het doelwit op de normale manier door te gaan, gebaseerd op de standaard merkers waarmee dit wordt geëvalueerd. Wanneer we echter verder gingen kijken naar enkele andere genen, observeerden we interessante verschillen. Eén van de genen die normaal dit proces aanwakkeren (gen A), was ontregeld in afwezigheid van het doelwit. Dit suggereert dat, wanneer het doelwit afwezig is, het proces op een andere manier doorgaat. Ook een gekende partner van ons doelwit (gen B) toonde een ander patroon. Hierdoor gingen we dieper in op de genen waarmee het doelwit samenwerkt in de cel. Van deze en nog andere partners werd al gezien dat ze in andere organen dan de pancreas een rol spelen in identiteitscrisissen van de cellen. We zullen deze dus allemaal verder testen.
Kunnen we het doelwit in mensen uitschakelen met medicatie?
Indien uit verder onderzoek blijkt dat dit een geschikt doelwit is voor het voorkomen van pancreaskanker, opent dit de deur naar een therapie. Momenteel zijn er twee stoffen op de markt die het doelwit kunnen blokkeren, waarvan er één al gebruikt wordt als medicijn voor reuma. Beiden worden nu in ons labo getest om te zien of dit medicijn geschikt zijn om het doelwit in de pancreascellen op een efficiënte manier te blokkeren. In een latere fase kan het effect in muizen getest worden, wat het pad effent voor testen in mensen.
We kunnen dus concluderen dat ons doelwit potentieel heeft voor een therapie ter verkoming van pancreaskanker. Hier is echter nog verder onderzoek voor nodig.
Spijtig genoeg hebben studies naar het behandelen van pancreaskanker tot dusver de sterftecijfers nog niet naar beneden kunnen halen. De filosofie van onze studie hield dus in om eerder te gaan voorkomen dat de kanker zich kan ontwikkelen, dit door de gunstige omstandigheden voor het starten van de kanker te blokkeren. Afsluiten doe ik graag met de woorden van Benjamin Franklin, die duidelijk onze gedachtegang deelt:
“An ounce of prevention is worth a pound of cure” ~Benjamin Franklin.
Bibliografie
1 Bengtsson, A., Andersson, R. & Ansari, D. The actual 5-year survivors of pancreatic ductal adenocarcinoma based on real-world data. Sci Rep 10, 16425, doi:10.1038/s41598-020-73525-y (2020).
2 Eurola, A. et al. Impact of histological response after neoadjuvant therapy on podocalyxin as a prognostic marker in pancreatic cancer. Sci Rep 11, 9896, doi:10.1038/s41598-021-89134-2 (2021).
3 Pinho, A. V. et al. Adult pancreatic acinar cells dedifferentiate to an embryonic progenitor phenotype with concomitant activation of a senescence programme that is present in chronic pancreatitis. Gut 60, 958-966, doi:10.1136/gut.2010.225920 (2011).
4 Wauters, E. et al. Sirtuin-1 regulates acinar-to-ductal metaplasia and supports cancer cell viability in pancreatic cancer. Cancer Res 73, 2357-2367, doi:10.1158/0008-5472.CAN-12-3359 (2013).
5 Backx, E. et al. MECOM permits pancreatic acinar cell dedifferentiation avoiding cell death under stress conditions. Cell Death Differ, doi:10.1038/s41418-021-00771-6 (2021).
6 Shi, C. et al. KRAS2 mutations in human pancreatic acinar-ductal metaplastic lesions are limited to those with PanIN: implications for the human pancreatic cancer cell of origin. Mol Cancer Res 7, 230-236, doi:10.1158/1541-7786.MCR-08-0206 (2009).
7 Storz, P. Acinar cell plasticity and development of pancreatic ductal adenocarcinoma. Nat Rev Gastroenterol Hepatol 14, 296-304, doi:10.1038/nrgastro.2017.12 (2017).
8 Akanuma, N. et al. Paracrine Secretion of Transforming Growth Factor β by Ductal Cells Promotes Acinar-to-Ductal Metaplasia in Cultured Human Exocrine Pancreas Tissues. Pancreas 46, 1202-1207, doi:10.1097/MPA.0000000000000913 (2017).
9 Liu, J. et al. TGF-β1 promotes acinar to ductal metaplasia of human pancreatic acinar cells. Sci Rep 6, 30904, doi:10.1038/srep30904 (2016).
10 Beel, S. et al. κB-Ras and Ral GTPases regulate acinar to ductal metaplasia during pancreatic adenocarcinoma development and pancreatitis. Nat Commun 11, 3409, doi:10.1038/s41467-020-17226-0 (2020).
11 Means, A. L. & Logsdon, C. D. Acinar Ductal Metaplasia: Yap Fills a Gap. Gastroenterology 151, 393-395, doi:10.1053/j.gastro.2016.07.022 (2016).
12 Lo, M., Ling, V., Wang, Y. Z. & Gout, P. W. The xc- cystine/glutamate antiporter: a mediator of pancreatic cancer growth with a role in drug resistance. Br J Cancer 99, 464-472, doi:10.1038/sj.bjc.6604485 (2008).
13 Daher, B. et al. Genetic Ablation of the Cystine Transporter xCT in PDAC Cells Inhibits mTORC1, Growth, Survival, and Tumor Formation via Nutrient and Oxidative Stresses. Cancer Res 79, 3877-3890, doi:10.1158/0008-5472.CAN-18-3855 (2019).
14 Rooman, I. et al. Amino acid transporters expression in acinar cells is changed during acute pancreatitis. Pancreatology 13, 475-485, doi:10.1016/j.pan.2013.06.006 (2013).
15 Wang, G. H. et al. Identification of MXRA5 as a novel biomarker in colorectal cancer. Oncol Lett 5, 544-548, doi:10.3892/ol.2012.1038 (2013).
16 Tang, Z., Li, C., Kang, B., Gao, G. & Zhang, Z. GEPIA: a web server for cancer and normal gene expression profiling and interactive analyses. Nucleic Acids Res 45, W98-W102, doi:10.1093/nar/gkx247 (2017).
17 Kalli, M. et al. Solid stress-induced migration is mediated by GDF15 through Akt pathway activation in pancreatic cancer cells. Sci Rep 9, 978, doi:10.1038/s41598-018-37425-6 (2019).
18 Zhao, Z. et al. Upregulated GDF-15 expression facilitates pancreatic ductal adenocarcinoma progression through orphan receptor GFRAL. Aging (Albany NY) 12, 22564-22581, doi:10.18632/aging.103830 (2020).
19 Hiraoka, N. et al. CXCL17 and ICAM2 are associated with a potential anti-tumor immune response in early intraepithelial stages of human pancreatic carcinogenesis. Gastroenterology 140, 310-321, doi:10.1053/j.gastro.2010.10.009 (2011).
20 Choreño-Parra, J. A., Thirunavukkarasu, S., Zúñiga, J. & Khader, S. A. The protective and pathogenic roles of CXCL17 in human health and disease: Potential in respiratory medicine. Cytokine Growth Factor Rev 53, 53-62, doi:10.1016/j.cytogfr.2020.04.004 (2020).
21 Fielder, G. C. et al. The GDNF Family: A Role in Cancer? Neoplasia 20, 99-117, doi:10.1016/j.neo.2017.10.010 (2018).
22 Kim, M. & Kim, D. J. GFRA1: A Novel Molecular Target for the Prevention of Osteosarcoma Chemoresistance. Int J Mol Sci 19, doi:10.3390/ijms19041078 (2018).
23 Rooman, I., Heremans, Y., Heimberg, H. & Bouwens, L. Modulation of rat pancreatic acinoductal transdifferentiation and expression of PDX-1 in vitro. Diabetologia 43, 907-914, doi:10.1007/s001250051468 (2000).
24 Broutier, L. et al. Culture and establishment of self-renewing human and mouse adult liver and pancreas 3D organoids and their genetic manipulation. Nat Protoc 11, 1724-1743, doi:10.1038/nprot.2016.097 (2016).
25 Ogihara, K. et al. Sulfasalazine could modulate the CD44v9-xCT system and enhance cisplatin-induced cytotoxic effects in metastatic bladder cancer. Cancer Sci 110, 1431-1441, doi:10.1111/cas.13960 (2019).
26 Suwannakul, N. et al. CD44v9 Induces Stem Cell-Like Phenotypes in Human Cholangiocarcinoma. Front Cell Dev Biol 8, 417, doi:10.3389/fcell.2020.00417 (2020).
27 Kim, D. H., Kim, W. D., Kim, S. K., Moon, D. H. & Lee, S. J. TGF-β1-mediated repression of SLC7A11 drives vulnerability to GPX4 inhibition in hepatocellular carcinoma cells. Cell Death Dis 11, 406, doi:10.1038/s41419-020-2618-6 (2020).
28 Lewerenz, J. et al. The cystine/glutamate antiporter system x(c)(-) in health and disease: from molecular mechanisms to novel therapeutic opportunities. Antioxid Redox Signal 18, 522-555, doi:10.1089/ars.2011.4391 (2013).
29 Meyer, A. R. et al. Cystine/Glutamate Antiporter (xCT) Is Required for Chief Cell Plasticity After Gastric Injury. Cell Mol Gastroenterol Hepatol 8, 379-405, doi:10.1016/j.jcmgh.2019.04.015 (2019).
30 Wada, T. et al. Functional role of CD44v-xCT system in the development of spasmolytic polypeptide-expressing metaplasia. Cancer Sci 104, 1323-1329, doi:10.1111/cas.12236 (2013).
31 Regulation of the Amino Acid Exchanger xCT (Slc7a11) in Acute Pancreatitis (researchgate.net)
32 Mvunta, D. H. et al. SIRT1 Regulates the Chemoresistance and Invasiveness of Ovarian Carcinoma Cells. Transl Oncol 10, 621-631, doi:10.1016/j.tranon.2017.05.005 (2017).
33 O'Callaghan, C. & Vassilopoulos, A. Sirtuins at the crossroads of stemness, aging, and cancer. Aging Cell 16, 1208-1218, doi:10.1111/acel.12685 (2017).
34 Ue, T. et al. Co-expression of osteopontin and CD44v9 in gastric cancer. Int J Cancer 79, 127-132, doi:10.1002/(sici)1097-0215(19980417)79:2<127::aid-ijc5>3.0.co;2-v (1998).
35 Chang, W. L. et al. Increased gastric osteopontin expression by Helicobacter pylori Infection can correlate with more severe gastric inflammation and intestinal metaplasia. Helicobacter 16, 217-224, doi:10.1111/j.1523-5378.2011.00832.x (2011).
36 Chang, W. L. et al. Osteopontin polymorphism increases gastric precancerous intestinal metaplasia susceptibility in Helicobacter pylori infected male. Future Oncol 13, 1415-1425, doi:10.2217/fon-2017-0006 (2017).









