Wat u (nog) niet weet over de vagina en de bacteriën die er leven
Iedereen wordt geboren. Iedereen komt daardoor tijdens de eerste minuten van het leven al in contact met bacteriën, afkomstig van de moeder. Die bacteriën laten ons daarna nooit meer los. De bacteriën waar een baby tijdens de geboorte mee in aanraking komt, spelen namelijk een belangrijke rol in de weerstand. De aanwezigheid van gezonde bacteriën in de vagina is dus van bijzonder belang voor de ontwikkeling van een baby, maar er hangt nog heel wat mysterie rond de micro-organismen die in de vagina verblijven. Om dit te ontrafelen werd in twee Afrikaanse populaties de rol van verschillende bacteriën in de vagina onderzocht, met als doel in de toekomst een gezonde ontwikkeling van alle pasgeboren baby’s te kunnen garanderen.
Vaginale microflora
Het menselijk lichaam bevat biljoenen bacteriën. Bij vrouwen bevindt een belangrijk deel daarvan zich in de vagina. Zij vormen de ‘vaginale microflora’. En maar goed ook, want een gezonde vaginale microflora verhindert het binnentreden van andere, ziekteverwekkende micro-organismen. Een verstoorde flora kan echter leiden tot symptomen zoals jeuk, bloedverlies of pijn en kan ernstige gevolgen hebben bij zwangerschap.
Informatie over de onderliggende oorzaken van zo’n verstoorde vaginale microflora ontbreekt. Ook is niet bekend welke micro-organismen de exacte boosdoeners zijn in een verstoorde flora. Eén veelvoorkomende vaginale aandoening is zogeheten bacteriële vaginose, maar ook dit blijft een zwaar onderbestudeerd probleem. Het is nochtans cruciaal om de vaginale microflora te onderzoeken, omdat de gezondheid van het vrouwelijk voortplantingsstelsel essentieel is voor zowel moeder als kind. De feminist in mij roept dus met gebalde vuist op voor meer awareness rond vaginale aandoeningen en destigmatisering rond vaginale gezondheid.
Bacteriële wat?!
Bacteriële vaginose is wereldwijd dé meest voorkomende gynaecologische aandoening bij vrouwen van vruchtbare leeftijd. Toch heeft u er waarschijnlijk nog nooit van gehoord. Het is nochtans een aandoening die uw aandacht verdient, want bacteriële vaginose is duidelijk verbonden met vroeggeboorte. In België wordt ongeveer 1 op de 10 baby’s te vroeg geboren (d.w.z. voor 37 volledige weken zwangerschap). In Afrikaanse landen ligt dat cijfer nog hoger en is vroeggeboorte dan ook een schrijnend probleem. U besefte het misschien niet eerder, maar vroeggeboorte is wereldwijd de op een na belangrijkste oorzaak (na longontsteking) van sterfte bij kinderen jonger dan 5 jaar. Daarbij komen ook nog de gevolgen voor het welzijn van de ouders en de enorme financiële last voor de maatschappij.
Patiënten met bacteriële vaginose hebben een verhoogde kans op vroeggeboorte bij zwangerschap. Het komt voor bij gemiddeld 1 op 4 vrouwen van vruchtbare leeftijd, maar veel patiënten ervaren geen specifieke symptomen en zijn zich er dus niet van bewust. “Maar wat is die bacteriële vaginose dan precies?”, hoor ik u denken. Bacteriële vaginose is, zoals het woord zegt, een bacteriële infectie van de vagina. Het kan symptomen veroorzaken als vaginale jeuk, een verkleurde afscheiding of een onaangename geur. De exacte bacteriën die deze symptomen veroorzaken zijn echter tot op de dag van vandaag niet grondig gekend.
Afrikaans onderzoek
Er zijn een aantal factoren waarvan men weet dat ze het risico op bacteriële vaginose verhogen. Uw vagina wassen met citroensap is bijvoorbeeld niet zo’n goed idee als u een gezonde flora wil behouden. Misschien trok u zopas een wenkbrauw op, maar in veel Afrikaanse landen zijn zo’n handelingen traditie. Daarom proberen onderzoekers vrouwen zo veel mogelijk in te lichten over wat wel en niet gezond is voor de vaginale microflora. Zo is in Ethiopië momenteel een studie lopende, waar deze masterscriptie deel van uitmaakte, die zwangere vrouwen aan de hand van filmpjes informeert over vaginale hygiëne. De theorie hierachter is dat bij deze geïnformeerde vrouwen minder bacteriële vaginose zal voorkomen en zo ook het aantal vroeggeboortes zal worden gereduceerd.
In diezelfde populatie zwangere vrouwen werd voor deze masterscriptie ook gekeken naar de omvang van het probleem van bacteriële vaginose. Er werd namelijk, zowel in Ethiopië als in de Democratische Republiek Congo, bestudeerd bij hoeveel procent van de vrouwen bacteriële vaginose voorkomt. Van de meer dan 500 onderzochte Afrikaanse vrouwen bleek ongeveer 15-25% positief te zijn voor deze aandoening (Figuur 1). Een enorm hoge prevalentie dus. Om dit even in perspectief te plaatsen: wereldwijd leefde in 2017 slechts 0.4-5.5% van de wereldbevolking met kanker, een aandoening waar u óngetwijfeld wel al over heeft gehoord.
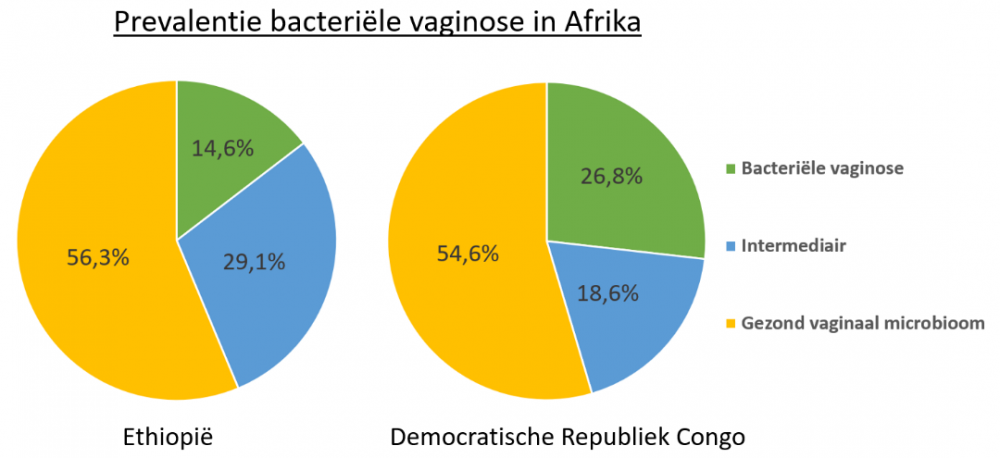
Figuur 1. Prevalentie van bacteriële vaginose in 2 Afrikaanse landen.
Goede en slechte bacteriën
Ondanks dat bacteriële vaginose een zeer frequente aandoening is met een wijd spectrum aan negatieve gevolgen, blijft het onderliggende probleem relatief onbekend. De ‘goede’ bacteriën, die een gezonde vaginale microflora opbouwen, zijn vrij goed beschreven maar de ‘slechte’ blijven momenteel onbekend. Als deel van deze masterscriptie werd daarom de rol van verschillende bacteriën in de vaginale gezondheid bestudeerd. Hiervoor werd bij meer dan 300 zwangere Congolese vrouwen, met en zonder klachten van bacteriële vaginose, een vaginaal uitstrijkje genomen. Met behulp van dat uitstrijkje werd dan onderzocht welke bacteriën er allemaal aanwezig zijn in de vagina van deze vrouwen. Zo kon een link gevonden worden tussen bacteriële vaginose en bepaalde symptomen en zwangerschapsuitkomsten zoals laag geboortegewicht en vroeggeboorte, maar het plaatje is niet helemaal zo zwart-wit. Het is namelijk niet zo dat één specifieke bacterie na deze studie kan aangeduid worden als ‘de slechterik’ die onaangename symptomen en vroeggeboorte veroorzaakt. Het is waarschijnlijker dat een samenspel tussen verschillende bacteriën aan de basis ligt van bacteriële vaginose.
Wetenschappelijk onderzoek en open communicatie rond vaginale gezondheid zijn vereist om bacteriële vaginose, en daarmee ook vroeggeboorte, te bestrijden. Deze masterscriptie droeg hier aan bij door het voorkomen van de aandoening in Afrika en het netwerk van bacteriën in de vagina te bestuderen. Ik hoop dat u na het lezen van dit artikel niet meer moet zeggen dat onderzoek naar de vaginale microflora belangrijk is. Want iedereen wordt geboren, en iedereen komt zo in contact met bacteriën van de moeder. In geval van bacteriële vaginose kan dat contact dodelijke gevolgen hebben. Ik denk dat u dat nog niet wist over de vagina en de bacteriën die er leven.
Bibliografie
1 Peebles, K., Velloza, J., Balkus, J. E., McClelland, R. S. & Barnabas, R. V. High global burden and costs of bacterial vaginosis: a systematic review and meta-analysis. Sex Transm Dis 46, 304-311, doi:10.1097/olq.0000000000000972 (2019).
2 Onderdonk, A. B., Delaney, M. L. & Fichorova, R. N. The human microbiome during bacterial vaginosis. Clin Microbiol Rev 29, 223-238, doi:10.1128/cmr.00075-15 (2016).
3 Schwebke, J. R. Gynecologic consequences of bacterial vaginosis. Obstet Gynecol Clin North Am 30, 685-694, doi:10.1016/s0889-8545(03)00086-x (2003).
4 Leitich, H. & Kiss, H. Asymptomatic bacterial vaginosis and intermediate flora as risk factors for adverse pregnancy outcome. Best Pract Res Clin Obstet Gynaecol 21, 375-390, doi:10.1016/j.bpobgyn.2006.12.005 (2007).
5 Doyle, R. M. et al. Bacterial communities found in placental tissues are associated with severe chorioamnionitis and adverse birth outcomes. PLoS One 12, e0180167, doi:10.1371/journal.pone.0180167 (2017).
6 Thurman, A. R. et al. Bacterial vaginosis and subclinical markers of genital tract inflammation and mucosal immunity. AIDS Res Hum Retroviruses 31, 1139-1152, doi:10.1089/aid.2015.0006 (2015).
7 Blencowe, H. et al. Born too soon: the global epidemiology of 15 million preterm births. Reprod Health 10 Suppl 1, S2, doi:10.1186/1742-4755-10-s1-s2 (2013).
8 Liu, L. et al. Global, regional, and national causes of under-5 mortality in 2000-15: an updated systematic analysis with implications for the Sustainable Development Goals. Lancet 388, 3027-3035, doi:10.1016/s0140-6736(16)31593-8 (2016).
9 Lee, A. C., Blencowe, H. & Lawn, J. E. Small babies, big numbers: global estimates of preterm birth. Lancet Glob Health 7, e2-e3, doi:10.1016/s2214-109x(18)30484-4 (2019).
10 Muzny, C. A. & Schwebke, J. R. Pathogenesis of bacterial vaginosis: discussion of current hypotheses. J Infect Dis 214 Suppl 1, 4/5, doi:10.1093/infdis/jiw121 (2016).
11 Verstraelen, H., Verhelst, R., Vaneechoutte, M. & Temmerman, M. The epidemiology of bacterial vaginosis in relation to sexual behaviour. BMC Infect Dis 10, 81, doi:10.1186/1471-2334-10-81 (2010).
12 Schwebke, J. R. & Desmond, R. Risk factors for bacterial vaginosis in women at high risk for sexually transmitted diseases. Sex Transm Dis 32, 654-658, doi:10.1097/01.olq.0000175396.10304.62 (2005).
13 Alcaide, M. L. et al. A cross-sectional study of bacterial vaginosis, intravaginal practices and HIV genital shedding; implications for HIV transmission and women's health. BMJ Open 5, e009036, doi:10.1136/bmjopen-2015-009036 (2015).
14 Chisembele, M., Rodriguez, V. J., Brown, M. R., Jones, D. L. & Alcaide, M. L. Intravaginal practices among young HIV-infected women in Lusaka, Zambia. Int J STD AIDS 29, 164-171, doi:10.1177/0956462417721438 (2018).
15 Muzny, C. A., Laniewski, P., Schwebke, J. R. & Herbst-Kralovetz, M. M. Host-vaginal microbiota interactions in the pathogenesis of bacterial vaginosis. Curr Opin Infect Dis 33, 59-65, doi:10.1097/qco.0000000000000620 (2020).
16 Vaneechoutte, M. The human vaginal microbial community. Res Microbiol 168, 811-825, doi:10.1016/j.resmic.2017.08.001 (2017).
17 Muzny, C. A. et al. An updated conceptual model on the pathogenesis of bacterial vaginosis. J Infect Dis 220, 1399-1405, doi:10.1093/infdis/jiz342 (2019).
18 Hardy, L., Cerca, N., Jespers, V., Vaneechoutte, M. & Crucitti, T. Bacterial biofilms in the vagina. Res Microbiol 168, 865-874, doi:10.1016/j.resmic.2017.02.001 (2017).
19 Verhelst, R. et al. Cloning of 16S rRNA genes amplified from normal and disturbed vaginal microflora suggests a strong association between Atopobium vaginae, Gardnerella vaginalis and bacterial vaginosis. BMC Microbiol 4, 16, doi:10.1186/1471-2180-4-16 (2004).
20 Vaneechoutte, M. et al. Emended description of Gardnerella vaginalis and description of Gardnerella leopoldii sp. nov., Gardnerella piotii sp. nov. and Gardnerella swidsinskii sp. nov., with delineation of 13 genomic species within the genus Gardnerella. Int J Syst Evol Microbiol 69, 679-687, doi:10.1099/ijsem.0.003200 (2019).
21 Knupp de Souza, D. M. et al. Antimicrobial susceptibility and vaginolysin in Gardnerella vaginalis from healthy and bacterial vaginosis diagnosed women. J Infect Dev Ctries 10, 913-919, doi:10.3855/jidc.7161 (2016).
22 Robinson, L. S., Schwebke, J., Lewis, W. G. & Lewis, A. L. Identification and characterization of NanH2 and NanH3, enzymes responsible for sialidase activity in the vaginal bacterium Gardnerella vaginalis. J Biol Chem 294, 5230-5245, doi:10.1074/jbc.RA118.006221 (2019).
23 Santiago, G. L. et al. Gardnerella vaginalis comprises three distinct genotypes of which only two produce sialidase. Am J Obstet Gynecol 204, 450.e451-457, doi:10.1016/j.ajog.2010.12.061 (2011).
24 Hardy, L. et al. The presence of the putative Gardnerella vaginalis sialidase A gene in vaginal specimens is associated with bacterial vaginosis biofilm. PLoS One 12, e0172522, doi:10.1371/journal.pone.0172522 (2017).
25 Lewis, W. G. et al. Hydrolysis of secreted sialoglycoprotein immunoglobulin A (IgA) in ex vivo and biochemical models of bacterial vaginosis. J Biol Chem 287, 2079-2089, doi:10.1074/jbc.M111.278135 (2012).
26 Schellenberg, J. J., Patterson, M. H. & Hill, J. E. Gardnerella vaginalis diversity and ecology in relation to vaginal symptoms. Res Microbiol 168, 837-844, doi:10.1016/j.resmic.2017.02.011 (2017).
27 Mohammadzadeh, R., Sadeghi Kalani, B., Kashanian, M., Oshaghi, M. & Amirmozafari, N. Prevalence of vaginolysin, sialidase and phospholipase genes in Gardnerella vaginalis isolates between bacterial vaginosis and healthy individuals. Med J Islam Repub Iran 33, 85, doi:10.34171/mjiri.33.85 (2019).
28 Pleckaityte, M., Janulaitiene, M., Lasickiene, R. & Zvirbliene, A. Genetic and biochemical diversity of Gardnerella vaginalis strains isolated from women with bacterial vaginosis. FEMS Immunol Med Microbiol 65, 69-77, doi:10.1111/j.1574-695X.2012.00940.x (2012).
29 Swidsinski, A. et al. Adherent biofilms in bacterial vaginosis. Obstet Gynecol 106, 1013-1023, doi:10.1097/01.AOG.0000183594.45524.d2 (2005).
30 Castro, J., Machado, D. & Cerca, N. Unveiling the role of Gardnerella vaginalis in polymicrobial bacterial vaginosis biofilms: the impact of other vaginal pathogens living as neighbors. Isme j 13, 1306-1317, doi:10.1038/s41396-018-0337-0 (2019).
31 Amsel, R. et al. Nonspecific vaginitis. Diagnostic criteria and microbial and epidemiologic associations. Am J Med 74, 14-22, doi:10.1016/0002-9343(83)91112-9 (1983).
32 Hardy, L. et al. A fruitful alliance: the synergy between Atopobium vaginae and Gardnerella vaginalis in bacterial vaginosis-associated biofilm. Sex Transm Infect 92, 487-491, doi:10.1136/sextrans-2015-052475 (2016).
33 Fredricks, D. N., Fiedler, T. L. & Marrazzo, J. M. Molecular identification of bacteria associated with bacterial vaginosis. N Engl J Med 353, 1899-1911, doi:10.1056/NEJMoa043802 (2005).
34 Vaneechoutte, M. Lactobacillus iners, the unusual suspect. Res Microbiol 168, 826-836, doi:10.1016/j.resmic.2017.09.003 (2017).
35 Institute of Medicine Committee on Understanding Premature, B. & Assuring Healthy, O. in Preterm Birth: Causes, Consequences, and Prevention (eds R. E. Behrman & A. S. Butler) (National Academies Press (US)
Copyright © 2007, National Academy of Sciences., 2007).
36 Goldenberg, R. L., Culhane, J. F., Iams, J. D. & Romero, R. Epidemiology and causes of preterm birth. Lancet 371, 75-84, doi:10.1016/s0140-6736(08)60074-4 (2008).
37 Tita, A. T. & Andrews, W. W. Diagnosis and management of clinical chorioamnionitis. Clin Perinatol 37, 339-354, doi:10.1016/j.clp.2010.02.003 (2010).
38 Goldenberg, R. L., Hauth, J. C. & Andrews, W. W. Intrauterine infection and preterm delivery. N Engl J Med 342, 1500-1507, doi:10.1056/nejm200005183422007 (2000).
39 Buve, A., Jespers, V., Crucitti, T. & Fichorova, R. N. The vaginal microbiota and susceptibility to HIV. Aids 28, 2333-2344, doi:10.1097/qad.0000000000000432 (2014).
40 Kyongo, J. K. et al. Cross-sectional analysis of selected genital tract immunological markers and molecular vaginal microbiota in Sub-Saharan African women, with relevance to HIV risk and prevention. Clin Vaccine Immunol 22, 526-538, doi:10.1128/cvi.00762-14 (2015).
41 Nugent, R. P., Krohn, M. A. & Hillier, S. L. Reliability of diagnosing bacterial vaginosis is improved by a standardized method of gram stain interpretation. J Clin Microbiol 29, 297-301 (1991).
42 Srinivasan, S. et al. More than meets the eye: associations of vaginal bacteria with gram stain morphotypes using molecular phylogenetic analysis. PLoS One 8, e78633, doi:10.1371/journal.pone.0078633 (2013).
43 Bradshaw, C. S. et al. High recurrence rates of bacterial vaginosis over the course of 12 months after oral metronidazole therapy and factors associated with recurrence. J Infect Dis 193, 1478-1486, doi:10.1086/503780 (2006).
44 Buffie, C. G. et al. Profound alterations of intestinal microbiota following a single dose of clindamycin results in sustained susceptibility to Clostridium difficile-induced colitis. Infect Immun 80, 62-73, doi:10.1128/iai.05496-11 (2012).
45 Schwebke, J. R., Marrazzo, J., Beelen, A. P. & Sobel, J. D. A phase 3, multicenter, randomized, double-blind, vehicle-controlled study evaluating the safety and efficacy of metronidazole vaginal gel 1.3% in the Treatment of Bacterial Vaginosis. Sex Transm Dis 42, 376-381, doi:10.1097/olq.0000000000000300 (2015).
46 Ma, D., Chen, Y. & Chen, T. Vaginal microbiota transplantation for the treatment of bacterial vaginosis: a conceptual analysis. FEMS Microbiol Lett 366, doi:10.1093/femsle/fnz025 (2019).
47 Landlinger, C. et al. Engineered phage endolysin eliminates Gardnerella biofilm without damaging beneficial bacteria in bacterial vaginosis ex vivo. Pathogens 10, doi:10.3390/pathogens10010054 (2021).
48 Li, T. et al. Antimicrobial susceptibility testing of metronidazole and clindamycin against Gardnerella vaginalis in planktonic and biofilm formation. Can J Infect Dis Med Microbiol 2020, 1361825, doi:10.1155/2020/1361825 (2020).
49 Kharsany, A. B., Hoosen, A. A. & Van den Ende, J. Antimicrobial susceptibilities of Gardnerella vaginalis. Antimicrob Agents Chemother 37, 2733-2735, doi:10.1128/aac.37.12.2733 (1993).
50 Tian, F., Li, J., Nazir, A. & Tong, Y. Bacteriophage - a promising alternative measure for bacterial biofilm control. Infect Drug Resist 14, 205-217, doi:10.2147/idr.S290093 (2021).
51 Abdelrahman, F. et al. Phage-encoded endolysins. Antibiotics (Basel) 10, doi:10.3390/antibiotics10020124 (2021).
52 Gonçalves, B. et al. Vulvovaginal candidiasis: epidemiology, microbiology and risk factors. Crit Rev Microbiol 42, 905-927, doi:10.3109/1040841x.2015.1091805 (2016).
53 Zeng, X. et al. Risk Factors of vulvovaginal candidiasis among women of reproductive age in Xi'an: a cross-sectional study. Biomed Res Int 2018, 9703754, doi:10.1155/2018/9703754 (2018).
54 Sobel, J. D. Vulvovaginal candidosis. Lancet 369, 1961-1971, doi:10.1016/s0140-6736(07)60917-9 (2007).
55 Mendling, W. & Brasch, J. Guideline vulvovaginal candidosis (2010) of the German Society for Gynecology and Obstetrics, the Working Group for Infections and Infectimmunology in Gynecology and Obstetrics, the German Society of Dermatology, the Board of German Dermatologists and the German Speaking Mycological Society. Mycoses 55 Suppl 3, 1-13, doi:10.1111/j.1439-0507.2012.02185.x (2012).
56 Mulinganya, G. et al. Vaginal Candida carriage among pregnant women attending antenatal care in Bukavu, Democratic Republic of the Congo: prevalence, risk factors and pregnancy outcomes (PLOS ONE, 2021).
57 Workowski, K. A. & Bolan, G. A. Sexually transmitted diseases treatment guidelines, 2015. MMWR Recomm Rep 64, 1-137 (2015).
58 Organization, W. H. Guide pour la prise en charge des infections sexuellement transmissibles. (Genève: Organisation mondiale de la Santé, 2005).
59 Schober, P., Boer, C. & Schwarte, L. A. Correlation coefficients: appropriate use and interpretation. Anesth Analg 126, 1763-1768, doi:10.1213/ane.0000000000002864 (2018).
60 Mengistie, Z., Woldeamanuel, Y., Asrat, D. & Adera, A. Prevalence of bacterial vaginosis among pregnant women attending antenatal care in Tikur Anbessa University Hospital, Addis Ababa, Ethiopia. BMC Res Notes 7, 822, doi:10.1186/1756-0500-7-822 (2014).
61 Mulu, W., Yimer, M., Zenebe, Y. & Abera, B. Common causes of vaginal infections and antibiotic susceptibility of aerobic bacterial isolates in women of reproductive age attending at Felegehiwot Referral Hospital, Ethiopia: a cross sectional study. BMC Womens Health 15, 42, doi:10.1186/s12905-015-0197-y (2015).
62 Bitew, A., Abebaw, Y., Bekele, D. & Mihret, A. Prevalence of bacterial vaginosis and associated risk factors among women complaining of genital tract infection. Int J Microbiol 2017, 4919404, doi:10.1155/2017/4919404 (2017).
63 Bitew, A. & Abebaw, Y. Vulvovaginal candidiasis: species distribution of Candida and their antifungal susceptibility pattern. BMC Womens Health 18, 94, doi:10.1186/s12905-018-0607-z (2018).
64 Tsega, A. & Mekonnen, F. Prevalence, risk factors and antifungal susceptibility pattern of Candida species among pregnant women at Debre Markos Referral Hospital, Northwest Ethiopia. BMC Pregnancy Childbirth 19, 527, doi:10.1186/s12884-019-2494-1 (2019).
65 Hill, J. E. & Albert, A. Y. K. Resolution and cooccurrence patterns of Gardnerella leopoldii, G. swidsinskii, G. piotii, and G. vaginalis within the vaginal microbiome. Infect Immun 87, doi:10.1128/iai.00532-19 (2019).
66 Petricevic, L. et al. Characterisation of the vaginal Lactobacillus microbiota associated with preterm delivery. Sci Rep 4, 5136, doi:10.1038/srep05136 (2014).
67 Fettweis, J. M. et al. The vaginal microbiome and preterm birth. Nat Med 25, 1012-1021, doi:10.1038/s41591-019-0450-2 (2019).
68 Tabatabaei, N. et al. Vaginal microbiome in early pregnancy and subsequent risk of spontaneous preterm birth: a case-control study. Bjog 126, 349-358, doi:10.1111/1471-0528.15299 (2019).